






科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子教课内容课件ppt
展开1.了解原子的构成,了解核电荷数、质子数和核外电子数的关系。2.了解原子质量是集中在原子核上。
在化学变化中分子可以再分,而原子不能再分。那么,原子究竟是不是简单而不可分割的实心球体呢?
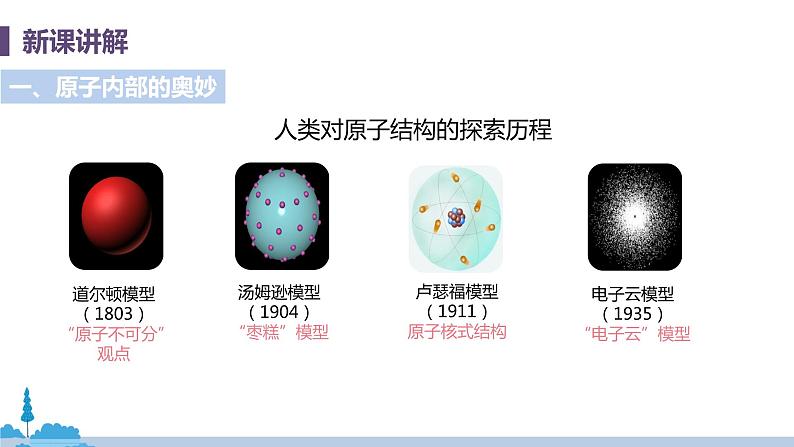
人类对原子结构的探索历程
英国物理学家卢瑟福著名的α粒子散射实验,为建立现代原子理论打下了基础。
原子是由居于中心的原子核和核外电子构成的。原子核是由质子和中子构成的。
每个质子带1单位正电荷。
核电荷数:原子核所带的正电荷数。
每个电子带1单位负电荷。
核电荷数=核内质子数。
并不是所有原子均由质子、中子、电子构成。如氢原子原子核内无中子。
观察下表不同原子中各微粒的数目,思考讨论下列问题:
(一个质子带一个单位正电荷)
(一个电子带一个单位负电荷)
注:原子核所带正电荷的数目称为核电荷数。
不同种类的原子,其核内质子数不同。(即原子的种类由质子数决定)
由于同一原子中,原子核里的质子和核外电子所带电荷数相等,且电性相反,所以整个原子不显电性。
特点:核外电子是分层运动的,这种分层运动也叫分层排布。
(1)各层最多能容纳的电子数为2n2个;
(2)最外层不超过8个(除第一层不超过2个);
(3)能量低的优先排满,依次再排能量逐步升高的电子层里。
思考 能否用一个更简明的图形来表示原子的结构及原子核外电子的排布特点?
科学家们为了形象直观、简便地表示原子的内部结构,设计了原子结构示意图。
原子里第一层最多排2个电子, 第二层最多排8个电子, 最外层电子数最多不超过8个(只有1层的不超过2个电子)。
质子个数为1-14的原子结构示意图,想一想有什么规律和特点。
2.原子中:核电荷数=质子数=核外电子数
核外电子排布规律1.原子核外第一层最多排2个电子,第二层最多排8个电子。2.最外层最多不超过8个电子,达到8个电子的惰性状态是稀有气体的稳定结构,如氦、氖、氩等。3.金属原子最外层的电子一般少于4个,在反应中较易失去电子,趋向于里层的稳定结构;非金属原子最外层的电子一般多于4个,在反应中较易得到电子趋向于本层的稳定结构。
1.化学变化中的最小粒子是( )A.原子B.分子C.质子D.中子2.氡原子的质子数为86,中子数为136,这种氡原子核外电子数为( )A.50B.86C.136D.222
3.有一种元素原子的核电荷数为49,中子数为66,则这种元素的原子的质子数和核外电子数分别为( )A.49 66 B.66 49 C.66 66 D.49 49
科粤版中考化学复习第4课时构成物质的微粒——分子、原子和离子教学课件: 这是一份科粤版中考化学复习第4课时构成物质的微粒——分子、原子和离子教学课件,共30页。PPT课件主要包含了化学性质,分子不断运动,化学变化,汞原子,氧原子,氧分子,阳离子,阴离子等内容,欢迎下载使用。
初中科粤版第二章 空气、物质的构成2.3 构成物质的微粒(Ⅱ)——原子和离子授课ppt课件: 这是一份初中科粤版第二章 空气、物质的构成2.3 构成物质的微粒(Ⅱ)——原子和离子授课ppt课件,共22页。PPT课件主要包含了原子内部结构,道尔顿,卢瑟福,汤姆逊,原子内部的奥秘,原子核,原子结构示意图,镁原子,电子层,质子数等内容,欢迎下载使用。
初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子背景图课件ppt: 这是一份初中化学科粤版九年级上册2.3 构成物质的微粒(Ⅱ)——原子和离子背景图课件ppt,文件包含第3课时相对原子质量离子课件ppt、第1课时原子的性质课件ppt、第3课时相对原子质量离子教案doc、第1课时原子教案doc、第2课时原子内部的奥秘教案doc、第2课时原子的结构课件ppt、卢瑟福原子模型标清mp4、氧化汞受热分解视频-_标清mp4、相对原子质量介绍视频-_标清mp4、道尔顿“原子论”模型简介视频-_标清mp4、钠在氯气中的燃烧-_标清mp4等11份课件配套教学资源,其中PPT共52页, 欢迎下载使用。













