




2022高三化学一轮复习优化探究 第八章 第25讲 水的电离及溶液的酸碱性课件PPT
展开2.水的离子积常数(1)表达式:__________________。(2)室温下:Kw=__________。(3)影响因素:只与温度有关,升高温度,Kw______。(4)适用范围:Kw不仅适用于纯水,也适用于稀的________水溶液。
Kw=c(H+)·c(OH-)
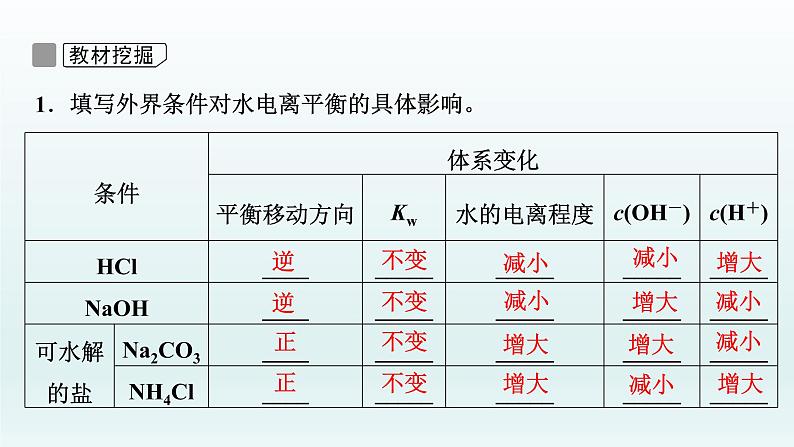
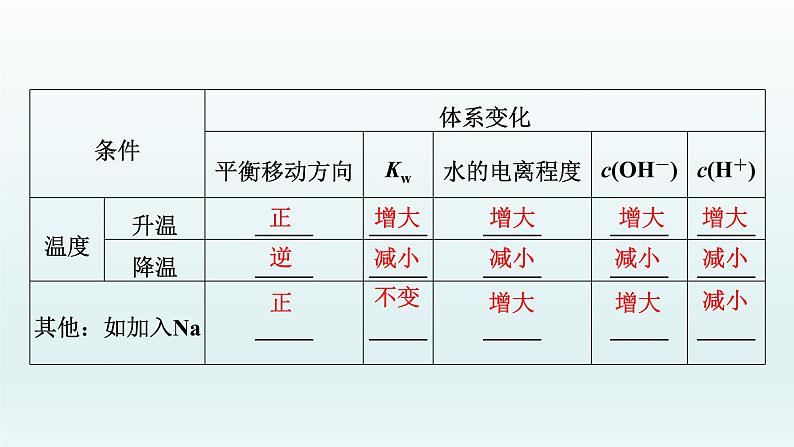
3.影响水电离平衡的因素(1)升高温度,水的电离程度______,Kw______。(2)加入酸或碱,水的电离程度______,Kw______。(3)加入可水解的盐(如FeCl3、Na2CO3),水的电离程度______,Kw______。
1.填写外界条件对水电离平衡的具体影响。
2.甲同学认为,在水中加入H2SO4溶液,水的电离平衡向左移动,解释是加入H2SO4溶液后c(H+)增大,平衡左移。乙同学认为,加入H2SO4溶液后,水的电离平衡向右移动,解释为加入H2SO4溶液后,c(H+)浓度增大,H+与OH-中和,平衡右移。你认为哪种说法正确?并说明原因。____________________________________________________________________________________________________________________________提示:甲正确,温度不变,Kw是常数,加入H2SO4,c(H+)增大,c(H+)·c(OH-)>Kw,平衡左移。
(1)水的电离平衡移动符合勒夏特列原理。( )(2)100 ℃的纯水中c(H+)=1×10-6 ml·L-1,此时水呈酸性。( )(3)室温下,0.1 ml·L-1的盐酸与0.1 ml·L-1的NaOH溶液中水的电离程度相等。( )(4)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。( )(5)某温度下,纯水中c(H+)=2.0×10-7 ml·L-1,则此时c(OH-)=5×10-8 ml·L-1。( )
题组一 水的电离平衡曲线1.如图表示不同温度下的水中c(H+)和c(OH-)的关系,下列判断错误的是( )A.两条曲线间任意点均有c(H+)·c(OH-)=KwB.M区域内任意点均有c(H+)<c(OH-)C.图中T1<T2D.XZ线上任意点均有pH=7
题组二 水电离出的c(H+)或c(OH-)的计算2.常温下,计算下列溶液中由水电离出的c(H+)或c(OH-)。(1)pH=2的盐酸:c(H+)水=________。(2)pH=11的NaOH溶液:c(OH-)水=________。(3)pH=2的FeCl3溶液:c(H+)水=________。(4)pH=11的Na2CO3溶液:c(OH-)水=________。
(4)pH=11,c(H+)=1×10-11 ml·L-1,c(OH-)=1×10-3 ml·L-1,在Na2CO3溶液中c(OH-)水=c(OH-)=1×10-3 ml·L-1。答案:(1)1×10-12 ml·L-1 (2)1×10-11 ml·L-1(3)1×10-2 ml·L-1 (4)1×10-3 ml·L-1
3.某温度下,Kw=1×10-12,计算下列溶液中水电离出的c(H+)或c(OH-)。(1)蒸馏水中c(H+)水=________。(2)0.1 ml·L-1 NaOH溶液中c(OH-)水=________。(3)pH=11的Na2CO3溶液中c(OH-)水=__________________。
答案:(1)1×10-6 ml·L-1 (2)1×10-11 ml·L-1 (3)0.1 ml·L-1
考点 2 溶液的酸碱性和pH1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。(1)酸性溶液:c(H+)____c(OH-),常温下,pH____7。(2)中性溶液c(H+)____c(OH-),常温下,pH____7。(3)碱性溶液c(H+)____c(OH-),常温下,pH____7。
2.pH及其测量(1)计算公式:pH=___________。(2)测量方法①pH试纸法用镊子夹取一小块pH试纸放在洁净的________或________上,用玻璃棒蘸取待测液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH。②pH计测量法
(3)溶液的酸碱性与pH的关系常温下:
用广泛pH试纸测溶液的pH时应注意什么问题?记录数据时又要注意什么?是否可用广泛pH试纸测定氯水的pH?____________________________________________________________________________________________________________________________提示:pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能产生误差;用pH试纸读出的pH只能是整数;不能用pH试纸测定氯水的pH,因为氯水呈现强氧化性(漂白性)。
(1)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性。( )(2)某溶液的c(H+)>10-7 ml·L-1,则该溶液呈酸性。( )(3)pH减小,溶液的酸性一定增强。( )(4)100 ℃时,Kw=1.0×10-12,0.01 ml·L-1盐酸的pH=2,0.01 ml·L-1的NaOH溶液的pH=10。( )(5)用蒸馏水润湿的pH试纸测溶液的pH,一定会使结果偏低。( )(6)用广泛pH试纸测得某溶液的pH为3.4。( )(7)一定温度下,pH=a的氯水,稀释10倍后,其pH=b,则a=b+1。( )
1.模型构建:计算溶液pH的一般思维模型
2.模型认知:25 ℃时,酸与碱等体积混合后溶液酸碱规律(1)等浓度等体积一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”。(2)25 ℃时,等体积、pH之和等于14的一强一弱酸碱混合溶液——“谁弱谁过量,谁弱显谁性”。(3)强酸、强碱等体积混合(25 ℃时):①pH之和等于14呈中性;②pH之和小于14呈酸性;③pH之和大于14呈碱性。
题组一 酸碱混合溶液酸碱性的判断1.常温下,两种溶液混合后酸碱性的判断(在括号中填“酸性”“碱性”或“中性”)。(1)相同浓度的HCl和NaOH溶液等体积混合。( )(2)相同浓度的CH3COOH和NaOH溶液等体积混合。( )(3)相同浓度的NH3·H2O和HCl溶液等体积混合。( )(4)pH=2的H2SO4和pH=12的NaOH溶液等体积混合。( )答案:(1)中性 (2)碱性 (3)酸性 (4)中性
(5)pH=3的HCl和pH=10的NaOH溶液等体积混合。( )(6)pH=3的HCl和pH=12的NaOH溶液等体积混合。( )(7)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合。( )(8)pH=2的H2SO4和pH=12的NH3·H2O等体积混合。( )答案:(5)酸性 (6)碱性 (7)酸性 (8)碱性
题组三 计算溶液的体积比3.在某温度时,测得0.01 ml·L-1的NaOH溶液的pH=11。(1)该温度下水的离子积常数Kw=________。(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。①若所得混合液为中性,且a=12,b=2,则Va∶Vb=________。②若所得混合液为中性,且a+b=12,则Va∶Vb=________。
答案:(1)1×10-13 (2)①1∶10 ②10∶1
考点 3 实验——酸碱中和滴定1.实验原理(1)原理:用已知浓度的酸(或碱)滴定未知浓度的碱(或酸),根据中和反应的等量关系来测定酸(或碱)的浓度。(2)实验关键①准确测定__________的体积。②准确判断__________。
(3)常用酸碱指示剂及变色范围
2.实验用品(1)仪器图(A)表示______滴定管,图(B)表示______滴定管,图(C)表示滴定装置及操作,其中含有的仪器是滴定管夹、铁架台、________以及两种滴定管。
(2)试剂标准液、待测液、指示剂、蒸馏水。(3)滴定管①构造:“0”刻度线在上方,尖嘴部分无刻度。②精确度:读数可估计到______ mL。③洗涤:先用蒸馏水洗涤,再用______液润洗。④排气泡:酸、碱式滴定管中的液体在滴定前均要排出尖嘴中的气泡。
3.实验操作(以标准盐酸滴定待测NaOH溶液为例)(1)滴定前的准备①滴定管:______→蒸馏水洗涤→用________润洗→装液→排气泡→调液面→记录。②锥形瓶:蒸馏水洗涤→装液→加指示剂。
(2)滴定 (3)终点判断:当滴入最后一滴标准液,指示剂变色,且在________内不恢复原来的颜色,视为滴定终点,并记录标准液的体积。
4.数据处理按上述操作重复2~3次,求出用去标准盐酸体积的平均值,根据_______________________计算。但要注意某个数值与其他数据相差较大时,应该舍去。
1.指示剂选择的基本原则变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致。(1)不能用石蕊做指示剂。(2)滴定终点为碱性时,用酚酞做指示剂。(3)滴定终点为酸性时,用甲基橙做指示剂,例如用盐酸滴定氨水。(4)强酸滴定强碱一般用甲基橙,但用酚酞也可以。
2.滴定管读数要领以凹液面的最低点为基准(如图)正确读数(虚线部分)和错误读数(实线部分)。
(2)以标准酸溶液滴定未知浓度的碱溶液(酚酞做指示剂)为例,常见的因操作不正确而引起的误差有:
题组一 中和滴定仪器及指示剂的选择1.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示仪器,从下表中选出正确选项( )
2.某实验室有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1~4.4,石蕊:5.0~8.0,酚酞:8.2~10.0。用0.100 0 ml·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是( )A.溶液呈中性,可选用甲基橙或酚酞做指示剂B.溶液呈中性,只能选用石蕊做指示剂C.溶液呈碱性,可选用甲基橙或酚酞做指示剂D.溶液呈碱性,只能选用酚酞做指示剂
解析:NaOH溶液和CH3COOH溶液恰好反应生成CH3COONa时,CH3COO-水解使溶液显碱性,而酚酞的变色范围为8.2~10.0,比较接近。
题组二 滴定数据的处理和误差分析3.某学生用0.200 0 ml·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数;④移取20.00 mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:(1)以上步骤有错误的是________(填编号),该错误操作会导致测定结果________(填“偏大”“偏小”或“无影响”)。(2)根据下列数据:请计算待测盐酸溶液的浓度为________ ml·L-1。
答案:(1)① 偏大 (2)0.200 0
滴定曲线(pH曲线)分析1.如图所示是强酸与强碱滴定过程中的pH曲线(以0.100 0 ml·L-1 NaOH溶液滴定20.00 mL 0.100 0 ml·L-1盐酸为例)
2.用强酸(碱)滴定弱碱(酸)的pH曲线比较
[提醒] 恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
[考能突破练]1.若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是( )
解析:由于稀氨水显碱性,首先排除选项A和C;两者恰好反应时溶液显酸性,排除选项D。
2.常温下,用0.10 ml·L-1 NaOH溶液分别滴定20.00 mL 0.10 ml·L-1 HCl溶液和20.00 mL 0.10 ml·L-1 CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法正确的是( )A.图2是滴定盐酸的曲线B.a与b的关系是a
3.如图曲线a和b是盐酸与NaOH的相互滴定的滴定曲线,下列叙述正确的是( )A.盐酸的物质的量浓度为1 ml·L-1B.P点时反应恰好完全,溶液呈中性C.曲线a是盐酸滴定NaOH的滴定曲线D.酚酞不能用作本实验的指示剂
解析:根据曲线a知,滴定前盐酸的pH=1,c(HCl)=0.1 ml·L-1,A错误;P点表示盐酸与NaOH恰好完全中和,溶液呈中性,B正确;曲线a是NaOH溶液滴定盐酸的曲线,曲线b是盐酸滴定NaOH溶液的曲线,C错误;强酸与强碱相互滴定,可以用酚酞作指示剂,D错误。
其他5类滴定实验与计算技巧1.氧化还原滴定[典例1] 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位为mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
Ⅱ.测定步骤a.安装装置,检验装置气密性,充入N2排尽空气后,停止充入N2。b.向三颈烧瓶中加入200 mL水样。c.向三颈烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。d.搅拌并向烧瓶中加入2 mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。e.从三颈烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.010 00 ml/L Na2S2O3溶液进行滴定,记录数据。f.……g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:步骤e中达到滴定终点的标志为____________。若某次滴定消耗Na2S2O3溶液4.50 mL,水样的DO=________ mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标________(填“是”或“否”)。
[答案] 溶液蓝色褪去且半分钟内不恢复蓝色 9.0 是
2.电势滴定[典例2] 某学习小组按如下实验流程探究海带中碘含量的测定。 取0.010 0 ml/L的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
请回答:(1)根据表中数据绘制滴定曲线: (2)该次滴定终点时用去AgNO3溶液的体积为________ mL,通过计算得到海带中碘的百分含量为________%。
[答案] (1)如图 (2)20.00 0.635
3.配位(络合)滴定[典例3] 无水MgBr2可用作催化剂。实验室用镁屑与液溴为原料制备无水MgBr2。为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++Y4-===MgY2-。测定时,先称取0.250 0 g无水MgBr2产品,溶解后,用0.050 0 ml/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________(以质量分数表示)。
[答案] AgCl 滴最后一滴AgNO3溶液时,有砖红色沉淀现象出现则达到终点 2.8×10-3
[解析]第一步:确定滴定反应与样品(絮凝剂)反应后剩余盐酸与NaOH溶液的反应。H+ + OH- === H2O 1 1 n c ml/L×V×10-3 L
1.稀溶液中c(H+)与c(OH-)之间的关系25 ℃时纯水中,c(H+)=c(OH-)=1×10-7 ml·L-1,Kw=c(H+)·c(OH-)=10-14,pH=-lg c(H+)=7。Kw不仅适用于纯水,还适用于酸性和碱性的稀溶液。不管哪种溶液均有c(H+)H2O=c(OH-)H2O如酸性稀溶液中:[c(H+)酸+c(H+)H2O]·c(OH-)H2O=Kw;碱性稀溶液中:[c(OH-)碱+c(OH-)H2O]·c(H+)H2O=Kw。
2.水的离子积常数表示在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,并且在稀酸或稀碱溶液中,当温度为25 ℃时,Kw=c(H+)·c(OH-)=1×10-14为同一常数。3.溶液酸碱性的判断:c(H+)>c(OH-),酸性;c(H+)=c(OH-),中性;c(H+)<c(OH-),碱性。4.滴定管使用四步骤:查漏→洗涤→润洗→装液。
1.判断正误,正确的打“√”,错误的打“×”。(1)(2018·高考全国卷Ⅲ)用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂。( )(2)(2016·高考海南卷)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁。( )(3)(2015·高考广东卷)用稀NaOH溶液滴定盐酸,用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定。( )(4)(2015·高考江苏卷)中和滴定时,滴定管用所盛装的反应液润洗2~3次。( )
2.(2018·高考全国卷Ⅰ)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 ml·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为________________,该样品中Na2S2O5的残留量为________g·L-1(以SO2计)。
3.(2018·高考全国卷Ⅱ)测定三草酸合铁酸钾中铁的含量。(1)称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c ml·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________。(2)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c ml·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________。
第29讲 水的电离及溶液的酸碱性-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第29讲 水的电离及溶液的酸碱性-备战2024年高考化学一轮复习精品课件(全国通用),共31页。PPT课件主要包含了考点1水的电离,2滴定等内容,欢迎下载使用。
2022版高考化学一轮复习课件:第8章 第2节 水的电离 溶液的酸碱性: 这是一份2022版高考化学一轮复习课件:第8章 第2节 水的电离 溶液的酸碱性,共60页。PPT课件主要包含了栏目导航,必备知识关键能力,☞知识点1水的电离,×10-14,-lgcH+,玻璃片,表面皿,标准液的体积,滴定终点,酸式滴定管等内容,欢迎下载使用。
2022高考化学一轮复习 第八章 第25讲 水的电离及溶液的酸碱性课件PPT: 这是一份2022高考化学一轮复习 第八章 第25讲 水的电离及溶液的酸碱性课件PPT,共60页。












