




初中化学鲁教版九年级下册第九单元 金属综合与测试授课课件ppt
展开(1)Y>X (2)Y>X
(1)铁 (2)稀盐酸;镁
Ag;过滤;Fe;A、C
1.【中考•黄冈】化学反应2Al+3CuSO4===3Cu+Al2(SO4)3,该反应的基本反应类型是( )A.化合反应 B.分解反应C.置换反应 D.复分解反应
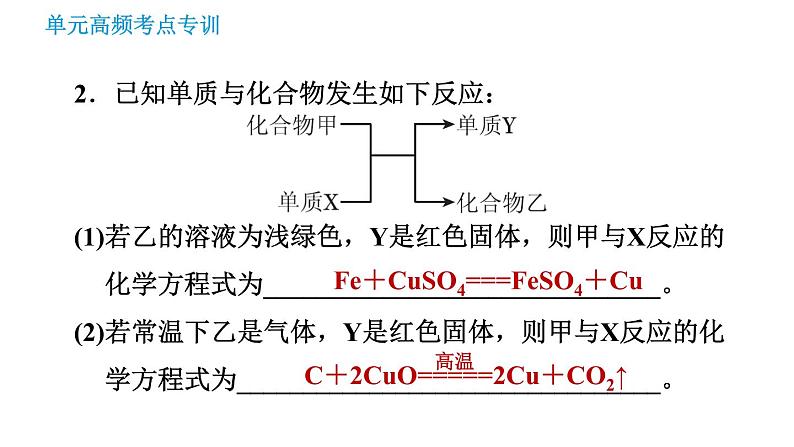
2.已知单质与化合物发生如下反应:(1)若乙的溶液为浅绿色,Y是红色固体,则甲与X反应的化学方程式为______________________________。(2)若常温下乙是气体,Y是红色固体,则甲与X反应的化学方程式为________________________________。
Fe+CuSO4===FeSO4+Cu
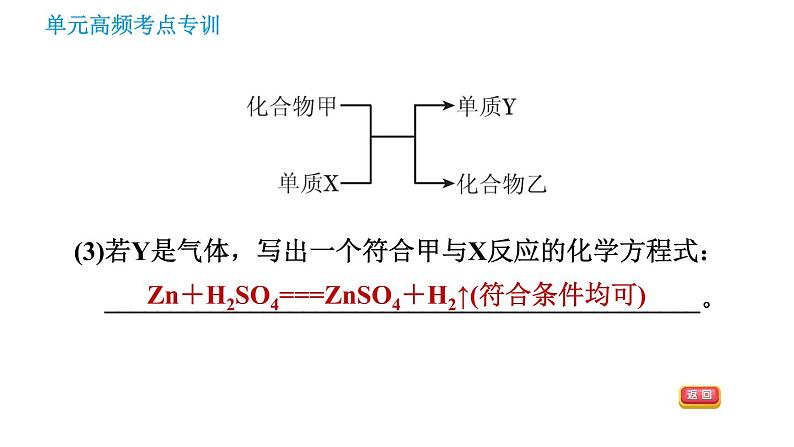
(3)若Y是气体,写出一个符合甲与X反应的化学方程式:_____________________________________________。
Zn+H2SO4===ZnSO4+H2↑(符合条件均可)
3.已知置换反应A+B===C+D能够发生。(1)若D为氢气,B为稀硫酸,则A的选择应满足的条件是______________________________________,写出一个符合条件的化学方程式:___________________________________________。
在金属活动性顺序中A位于氢前
Fe+H2SO4===FeSO4+H2↑
(2)若A、D为金属单质,写出一个符合条件的化学方程式:_______________________________________。(3)若D为铜,则化合物B可能为__________________(填化学式),并写出符合条件的化学方程式:__________________________________________________________________________________________。
CuO(或CuSO4)
4.用Mg、Al、Zn、Fe四种金属分别与稀硫酸反应,若要得到等质量的氢气,消耗这四种金属的质量由多到少的顺序为____________________。如果用等质量的上述四种金属分别与足量的稀硫酸反应,完全反应后,产生氢气的质量由多到少的顺序为____________________。
Zn>Fe>Mg>Al
Al>Mg>Fe>Zn
如果将足量的上述四种金属放入等质量、等浓度的稀硫酸中,完全反应后,产生氢气的质量关系为____________________________________________。
四种金属产生的H2质量均相等
5.【2020•龙东】某兴趣小组在研究Zn-Cu合金、Zn-Fe合金、Fe-Al合金、Fe-Cu合金时,发现其中一种合金6.5 g与足量稀盐酸充分反应产生了0.5 g气体,该合金可能是( )A.Zn-Cu合金 B.Zn-Fe合金C.Fe-Al合金 D.Fe-Cu合金
【方法规律】解答本题可采用极值法。6.5 g Zn-Cu合金中,6.5 g Zn与足量稀盐酸充分反应产生氢气的质量是0.2 g,铜与稀盐酸不反应,则充分反应产生氢气的质量小于0.2 g,A错误;6.5 g Fe与足量稀盐酸充分反应产生氢气的质量是0.23 g,所以6.5 g Zn-Fe合金与足量稀盐酸充分反应产生氢气的质量大于0.2 g,小于0.23 g ,B错误;
6.5 g Al与足量稀盐酸充分反应产生氢气的质量是0.72 g,所以6.5 g Fe-Al合金与足量稀盐酸充分反应产生氢气的质量大于0.23 g,小于0.72 g,C正确; 6.5 g Fe-Cu合金与足量稀盐酸充分反应产生氢气的质量小于0.23 g,D错误。
6.【中考•绵阳】现有铁与另一种金属组成的混合物1.2 g,与足量稀硫酸反应生成H2 0.1 g,则混合物中的另一种金属可能是( )A.Mg B.Al C.Zn D.Cu
【方法规律】本题采用极值法解答。假设纯净的铁与足量的稀硫酸反应,生成0.1 g氢气需要铁的质量为2.8 g,而铁与另一种金属混合与稀硫酸反应,生成0.1 g氢气只需要1.2 g金属,说明另一种金属与稀硫酸反应时一定是不足1.2 g金属即产生0.1 g氢气,符合条件的只有铝。
7.【中考•齐齐哈尔,双选题】现有锌和另一种金属组成的合金6.5 g,洋洋同学向此合金中加入100 g一定溶质质量分数的稀盐酸,充分反应后发现金属完全消失,若产生氢气的质量为m,则下列判断正确的是( )
A.如果合金为锌和铁,m不可能是0.2 gB.反应后溶液中的溶质只有两种C.如果合金为锌和镁,m可能是0.1 g,则该合金中锌的质量分数为50%D.如果合金为锌和铁,所加稀盐酸浓度一定大于7.3%
【点拨】纯净的锌6.5 g与稀盐酸完全反应产生0.2 g氢气,等质量的铁与酸完全反应,产生氢气的质量比锌多,因此若合金为锌和铁,则m一定大于0.2 g,故A正确;分析题意可知,两种金属已完全反应,生成了两种可溶性的盐,而盐酸可能没有完全反应,因此反应后溶液中的溶质可能是两种,也可能是三种,故B错误;
如合金是锌和镁,不管合金中锌的质量分数为多少,与稀盐酸完全反应后产生氢气的质量一定大于0.2 g,m不可能为0.1 g,故C错误;如果合金是锌和铁,则完全反应产生氢气的质量一定大于0.2 g,则消耗HCl的质量大于7.3 g,所加稀盐酸溶质的质量分数大于7.3%,故D正确。
8.向已调平的托盘天平两边各放一只盛有等质量、等质量分数的稀硫酸的烧杯。向左边烧杯中加入一定质量的金属X,同时向右边烧杯中加入相同质量的金属Y,观察到天平指针先偏向左边,当两种金属完全溶解后,天平指针又偏向右边(注:反应中X、Y都生成+2价的硫酸盐)。则:
(1)X、Y两种金属的活动性由强到弱的顺序为_______________。(2)X、Y两种金属的相对原子质量由大到小的顺序为_______________。
【点拨】(1)由天平指针先偏向左边,说明左边的金属X与酸反应产生氢气的速率慢,右边的金属Y与酸反应产生氢气的速率快,则金属活动性:Y>X;(2)当两种金属完全溶解后,天平指针又偏向右边,说明等质量的金属Y完全反应产生氢气的质量少,金属X产生的氢气多,且X、Y在生成物中的化合价相同,则X的相对原子质量小于Y。
9.将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左、右两盘上,调节至平衡,向两只烧杯中分别放入质量相等的镁和铁,待反应停止后,请判断:(1)若天平失去平衡,则指针一定偏向放______的一边。(2)若天平仍保持平衡,烧杯中一定没有剩余的物质是________,一定有剩余的是________。
【点拨】(1)若天平失去平衡,说明两边产生的氢气质量不相等,等质量的镁与酸反应产生氢气的质量比铁多,故指针一定偏向加铁的一边;(2)若天平仍保持平衡,说明两边产生氢气的质量相等,则两边的盐酸反应完,而与等质量的HCl反应,消耗的金属镁的质量小于金属铁,故两种金属中镁一定有剩余,而铁可能有剩余,也可能恰好完全反应。
10.【中考•枣庄】向等质量的锌粉和铁粉中分别加入足量稀硫酸,下列图像描述正确的是( )
【点拨】等质量的锌粉、铁粉与足量的稀硫酸反应,由于锌与酸反应产生氢气的速率较快,因此坡度陡;又由于等质量的锌、铁与酸完全反应后,铁产生的氢气较多,故最终铁与酸反应的曲线高度较高。
11.【2020•滨州】现有质量相等的甲、乙、丙三种金属,分别放入三份浓度相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是( )A.完全反应所需时间:丙>甲>乙B.生成氢气的质量:甲>乙>丙C.相对原子质量:乙>丙>甲D.消耗硫酸的质量:甲>乙>丙
【点拨】甲、乙、丙在生成物中均显+2价,稀硫酸足量,相对原子质量越大,生成的氢气质量越小,因此相对原子质量:丙>乙>甲,C不正确。
12.【中考•济宁】在相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,其发生反应的质量关系如图所示。读图并判断,下列推理合理的是( )①反应速率:Mg>Fe>Zn②反应生成氢气质量:Mg=Fe=Zn③反应后溶液质量:Mg=Fe=Zn④反应后溶液溶质质量分数:Mg
13.将等质量的锌粉和铁粉,分别放入质量相等、浓度相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,请回答下列问题。(1)写出锌与稀硫酸反应的化学方程式:__________________________。该反应的基本反应类型为___________反应。
Zn+H2SO4===ZnSO4+H2↑
(2)对于该图像的理解,下列说法正确的是________(填序号)。①A表示锌和稀硫酸的反应曲线②反应结束后两种金属一定都有剩余③反应结束后稀硫酸都没有剩余④反应结束后消耗两种金属的质量相等⑤反应结束后所得溶液质量相等
【点拨】由图像可知,A产生氢气的速率比B快,说明A比B活泼,故A表示锌和稀H2SO4的反应曲线,B表示铁和稀H2SO4的反应曲线,①正确;由图像知最终产生氢气的质量相等,说明反应结束后消耗的硫酸质量相同,即硫酸完全反应,故③正确;而产生等质量的氢气消耗的铁比锌少,故铁一定有剩余,锌可能有剩余,故②、④错误;
由于参加反应的硫酸质量相同,消耗的锌和铁质量不同,生成的氢气质量相同,根据质量守恒定律,所得溶液的质量一定不同,故⑤错误。
14.小东同学向盛有硝酸锌和硝酸银混合液的烧杯中加入一定量的铁粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生,下列说法正确的是( )A.滤液中一定含有硝酸亚铁,一定没有硝酸银和硝酸锌B.滤液中一定含有硝酸锌,一定没有硝酸亚铁和硝酸银C.滤渣中一定含有银和铁,一定没有锌D.反应后滤液的质量大于反应前溶液的质量
【点拨】铁的金属活动性比银强,比锌弱,不能与硝酸锌溶液反应;向盛有硝酸锌和硝酸银混合液的烧杯中加入一定量的铁粉,铁能与AgNO3溶液反应生成硝酸亚铁溶液和银;反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生,说明滤渣中含有能与稀盐酸反应的金属,该金属应为铁,说明铁是过量的。滤液中一定含有硝酸亚铁、硝酸锌,一定没有硝酸银,A、B错误,C正确;由反应时的质量关系可知,每56份质量的铁可置换出216份质量的银,反应后溶液的质量会减少,D错误。
15.【中考•潍坊】向m g AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入Zn,充分反应后过滤,所得滤液质量仍为m g。下列说法正确的是( )A.滤渣中一定有Ag、Cu、FeB.滤液中一定没有AgNO3C.滤液中一定含有Zn(NO3)2、Fe(NO3)2D.该过程至少发生了三个化学反应
【点拨】锌和硝酸银、硝酸铜、硝酸亚铁反应的化学方程式及其质量关系为Zn+2AgNO3===Zn(NO3)2+2Ag, 65 216Zn+Cu(NO3)2===Zn(NO3)2+Cu 65 64Zn+Fe(NO3)2===Zn(NO3)2+Fe, 65 56
由以上质量关系可知,锌和硝酸银反应后溶液质量减小,和硝酸铜、硝酸亚铁反应后溶液质量增大,因为充分反应后过滤,得到滤液的质量仍为m g,说明硝酸银完全反应,硝酸铜也参加了反应,无法确定硝酸亚铁是否参加了反应,因此滤渣中一定有反应生成的Ag、Cu; 此时滤液中一定含有的溶质是Zn(NO3)2,一定没有AgNO3。故选B。
16.【2020•齐齐哈尔,双选题】向硝酸银溶液中加入一定质量的锌粉和铜粉的混合物,充分反应后过滤,得到滤渣和滤液。以下推断正确的是( )A.若向滤渣中加入稀盐酸有气泡产生,则滤渣中一定有银、铜、锌B.若滤液为无色,则滤渣中一定有锌C.若滤液为蓝色,则滤液中一定有硝酸银、硝酸铜和硝酸锌D.滤渣的质量一定比反应前锌粉和铜粉混合物质量大
17.【中考•邵阳】将锌片分别放入下列四种溶液中,一段时间后,溶液质量会减轻的是( )A.H2SO4 B.AgNO3 C.FeSO4 D.MgSO4
【点拨】金属与酸、与盐溶液反应后,所得溶液质量变化情况为“进少出多,溶液质量减轻;进多出少,溶液质量增加”。每65 g锌与足量H2SO4反应时,只置换出2 g氢气;与FeSO4反应时,每65 g锌置换出56 g铁;这两种都是“进多出少”,溶液质量增加。只有与AgNO3溶液反应时,每65 g锌能置换出216 g银,“进少出多”,溶液质量减轻。锌与MgSO4溶液不能反应,溶液质量不变。
18.如图所示,在等臂杠杆两端各系一个等质量的铁球,调平后将球分别浸没在等质量、等质量分数的稀H2SO4和CuSO4溶液中,过一段时间后,杠杆将会( ) A.左端上翘 B.右端上翘C.保持平衡 D.无法判断
【点拨】将铁球浸入稀硫酸中,铁与稀硫酸反应,质量减轻,将铁球浸入硫酸铜溶液中,铁置换出硫酸铜中的铜,质量增加,故杠杆将会失去平衡,左端上翘,右端下沉。
19.【中考•荆州】如图所示,弹簧秤下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧秤读数为F1,再向烧杯中加入适量的铜粉,充分搅拌并静置足够长的时间后,溶液体积未变,此时弹簧秤的读数为F2。已知重物与前、后溶液均不发生任何反应,对于F1和F2的相对大小,下列说法正确的是( )A.无法判断 B.F1
【点拨】向烧杯中加入铜粉后,由于铜能与AgNO3溶液发生置换反应,每溶解64份质量的铜能置换出216份质量的银,所以溶液质量会减小,而溶液的体积不变,则溶液的密度减小,重物所受的浮力减小,弹簧秤的读数增大。
20.【中考•郴州】现有铜与另一种金属M的混合物(M可能是Al、Fe或Ag),在该混合物中加入足量的稀硫酸,有气泡产生,则M不可能是________,待反应完全后________(填实验操作方法),得到铜和滤液,在滤液中加入锌片,其表面有一层黑色物质,则M是________。
取一定量的原混合物投入到一定量的AgNO3溶液中,充分反应后,对反应所得溶液和固体推断正确的是________。A.溶液中一定有M的离子 B.固体中一定有Ag和CuC.固体中一定有AgD.溶液中一定有Ag+
【点拨】由向混合物中加入稀硫酸有气泡产生,说明金属M在金属活动性顺序中位于氢前,是Al或Fe中的一种,故不可能是Ag;将铜与滤液分开的操作为过滤;向滤液中加入锌片,表面有一层黑色物质,由此可知锌能置换出M,且置换出的金属M为黑色,则M应为Fe而不是Al;
取Cu、Fe的混合物放入AgNO3溶液中,则Fe先与AgNO3溶液反应生成Ag和Fe(NO3)2,若铁粉反应完全,而AgNO3有剩余,则Cu与未反应完的AgNO3溶液反应,故滤渣中一定有银,可能有Cu和Fe,滤液中一定有Fe(NO3)2,可能有Cu(NO3)2和AgNO3。
21.【中考•通辽】金属在生产生活中有广泛应用。(1)铝可以制成铝箔,这是利用金属铝具有良好的____________。(2)我国是世界上最早采用湿法冶金提取铜的国家。铁和硫酸铜溶液反应的化学方程式为______________________________。
(3)现有两种金属单质组成的混合物,向100 g某稀盐酸中加入该混合物,混合物的质量与生成氢气的质量关系如图所示。
下列说法不正确的一项是________。A.若混合物为Zn、Al,则m可能是0.2 gB.若混合物为Zn、Cu,则m=0.2 gC.若混合物为Fe、Al,则稀盐酸中溶质质量分数一定大于7.3%D.若混合物为Fe、Cu,m=0.1 g,则混合物中Fe的质量分数为50%
【点拨】根据计算可知5.6 g铁与足量稀盐酸反应会产生0.2 g氢气,而5.6 g铝与足量酸反应产生氢气的质量大于0.2 g,5.6 g锌与足量酸反应产生氢气的质量小于0.2 g,铜不与稀酸反应。若混合物为Al、Zn,则m可能为0.2 g,故A正确;若混合物为Zn、Cu,则m一定小于0.2 g,故B错误;
初中化学鲁教版九年级下册第十一单元 化学与社会发展综合与测试教学课件ppt: 这是一份初中化学鲁教版九年级下册第十一单元 化学与社会发展综合与测试教学课件ppt,共34页。PPT课件主要包含了答案呈现,CH4,燃烧产物是水无污染,KH2PO4,催化净化,化学或氢,或热值高,铁或Fe,Na2CO3等内容,欢迎下载使用。
鲁教版九年级下册化学课件 期末高频考点专训 专训3 物质间的反应关系: 这是一份初中鲁教版本册综合授课课件ppt,共38页。PPT课件主要包含了答案呈现,NaOH,H2OCO2,氢氧化钠和硫酸,CaOH2,金属活动性,合理答案均可,氧化物等内容,欢迎下载使用。
化学九年级下册第八单元 海水中的化学综合与测试图片ppt课件: 这是一份化学九年级下册第八单元 海水中的化学综合与测试图片ppt课件,共49页。PPT课件主要包含了答案呈现,甲乙丙,降温结晶,加入溶质或升温,∶19,溶解度相等,①③④⑤⑥,不饱和等内容,欢迎下载使用。













