




初中化学鲁教版 (五四制)九年级全册3 远离有毒物质习题课件ppt
展开
这是一份初中化学鲁教版 (五四制)九年级全册3 远离有毒物质习题课件ppt,共25页。PPT课件主要包含了答案呈现,混合物,13%,氯化钠,蒸发浓缩,海水=ⅠⅡⅢ,MgOH2,检查装置气密性,无明显现象,撤导管等内容,欢迎下载使用。
1.浩瀚无际的海洋为人类提供了丰富的资源。由海水制备金属镁,主要有以下步骤:①电解熔融的氯化镁;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )A.②④⑤③① B.③②④①⑤C.③④②⑤① D.②④③⑤①
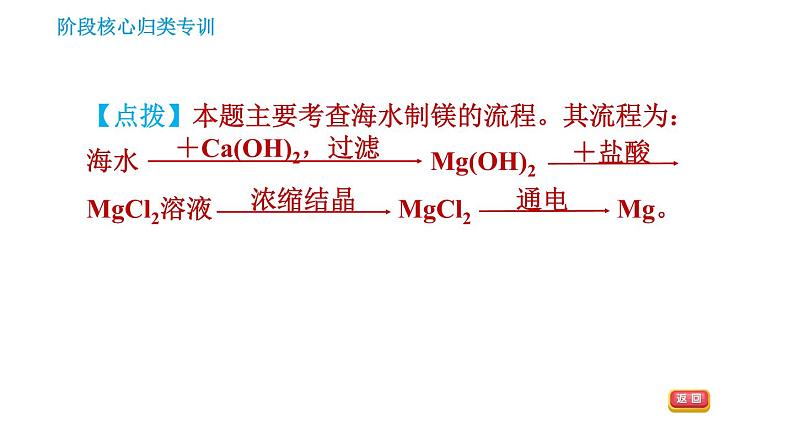
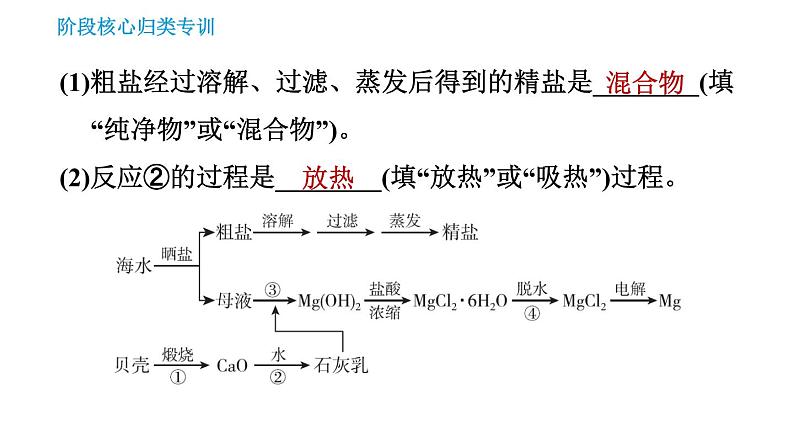
2.【2020·常州改编】2020年6月23日,我国“长征五号”B运载火箭搭载第55颗北斗导航卫星发射成功,“北斗三号”全球卫星导航系统星座部署全面完成。人造地球卫星的结构材料常用镁合金等,金属镁可从海水中提取,工艺流程如图所示:
(1)粗盐经过溶解、过滤、蒸发后得到的精盐是________(填“纯净物”或“混合物”)。(2)反应②的过程是________(填“放热”或“吸热”)过程。
(3)已知某海域海水中总的含盐量约为3.5%,盐中镁元素的质量分数约为3.7%,则海水中镁元素的质量分数约为______(保留两位有效数字),由此可知,用海水晒盐后剩余的“母液”来提取镁,而不直接用海水的主要原因是________________________________________________。
海水中镁元素含量很低,“母液”中镁元素含量较高
3.海水晒盐时,人们常把海水引进盐田,经过风吹日晒,海水中的水分蒸发获得粗盐,在此过程中( )A.水的质量不变B.氯化钠的质量不变C.氯化钠的质量分数始终不变D.氯化钠的质量分数变小
【点拨】 海水晒盐的原理是利用风吹日晒,使海水中的水分蒸发,使氯化钠从溶液中结晶出来。在此过程中,水的质量逐渐减少,食盐的质量不变,氯化钠的质量分数开始时逐渐增大,后不变。
4.海水中含有丰富的物质,是一种重要的资源,其中部分物质的溶解度曲线如图所示。(1)80 ℃时,溶解度最小的物质是____________。
(2)利用海水提取食盐的过程如下。海水→Ⅰ.贮水池→Ⅱ.池→Ⅲ.结晶池海水中的泥沙在贮水池中沉降,粗盐在结晶池中结晶析出,由此推测Ⅱ池的作用是_________,海水及三个步骤溶液中的氯化钠质量分数的关系是________________ (用“海水”“Ⅰ” “Ⅱ” “Ⅲ” “>”“<”“=”表示)。
(3)结晶池的母液中含有多种物质,将其加热到80 ℃以上,蒸发水分、过滤,得到的晶体中含有的物质是__________________。
【点拨】 (1)由图可知,80 ℃时氯化钠的溶解度最小;(2)因为氯化钠的溶解度受温度变化影响不大,所以采用蒸发结晶的方法提取食盐;工业上提取食盐的步骤为:海水进入贮水池,再依次进入蒸发池、结晶池,经过滤可得到母液和粗盐,粗盐进一步提纯为精盐。故蒸发池的作用是蒸发浓缩;在贮水池中水分未蒸发,氯化钠的质量分数等于海水中氯化钠的质量分数,在蒸发池中海水被蒸发,氯化钠的质量分数增大,在结晶池中氯化钠结晶析出,质量分数最大。故海水及三个步骤溶液中氯化钠的质量分数的大小关系是:海水=Ⅰ<Ⅱ<Ⅲ;
(3)观察溶解度曲线,当温度大于80 ℃时,随着温度的升高,硝酸钾和氯化钾的溶解度逐渐增大,而硫酸镁的溶解度反而减小,氯化钠的溶解度一直比较小,所以这两种物质就会结晶析出。
5.【2020·长春】粗盐中除了含有NaCl外,还含有少量Na2SO4、CaCl2、MgCl2及泥沙等杂质。如图是常用的粗盐精制操作流程,回答下列问题:(1)操作1相当于实验室中的________操作。(2)沉淀1的化学式为____________。
(3)加入过量试剂1的目的是_____________________________。(4)滤液4中含有的阴离子是__________________(填离子符号)。
除去溶液中的硫酸根离子
Cl-、OH-、CO32-
【点拨】(1)操作1是将泥沙与滤液分离,相当于实验室的过滤操作。(2)沉淀1是氯化镁与氢氧化钠溶液反应生成的氢氧化镁沉淀,沉淀1的化学式为Mg(OH)2。(3)加入碳酸钠溶液要放在加入氯化钡溶液之后,试剂1是氯化钡溶液,加入过量试剂1的目的是除去溶液中的硫酸根离子。(4)滤液4是氯化钠、氢氧化钠和碳酸钠的混合溶液,含有的阴离子是氯离子、氢氧根离子、碳酸根离子,其离子符号分别为Cl-、OH-、CO32-。
6.如图所示为“蒸馏法淡化海水”的实 验,请回答下列问题: (1)实验开始应先__________________。(2)向试管中加入5~10 mL海水,塞好胶塞加热,然后往小试管冷凝的水中加入硝酸银溶液,观察到的现象为________________。
(3)下列哪种方法冷凝效果最好( )A.玻璃管加长B.在烧杯内加冰块 C.使用冷凝器(4)实验结束时应该先____________(填“撤导管”或“熄灭酒精灯”),这样做的目的是____________________________。
(5)某同学向海水里加入硝酸银溶液做对比实验,发现有白色沉淀产生,该反应的化学方程式为______________________________________________________ (写一个)。
NaCl+AgNO3===AgCl↓+NaNO3(合理即可)
7.我国科学家侯德榜在氨碱法的基础上创立了更为先进的联合制碱法(侯氏制碱法),其生产流程简明如图所示:请读识流程图并回答下列问题:(1)写出沉淀池中发生反应的化学方程式:________________________________________________。(2)上述流程中气体X的化学式是___________。(3)沉淀池中晶体转移至焙烧炉时用到操作①,操作①的名称是________。
NaCl+H2O+NH3+CO2===NH4Cl+NaHCO3
8.烟台有漫长的海岸线,蕴藏着丰富的海洋资源。(1)海水淡化。可以采用如图1所示的膜分离法淡化海水,水分子可以通过淡化膜(海水中体积较大的盐的离子和其他分子不能通过)进入左侧的淡水池,从而得到淡水。下列说法中正确的是__________(填字母)。A.膜分离法的原理与滤纸过滤原理类似B.膜分离法还可以浓缩海水中的盐类物质C.膜分离法也是一种分离混合物的方法D.该膜分离法的目的是除去海水中的不溶物
(2)粗盐提纯。除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42-等杂质离子,为得到较纯的氯化钠,进行如下的实验操作:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液; ④加入适量的盐酸调节溶液的pH等于7;⑤过滤;⑥蒸发。下列操作顺序正确的是______(填字母),其中操作④加入适量的盐酸调节溶液的pH等于7的目的是_________________________________________。A.①③②④⑤⑥ B.③②①④⑤⑥C.③①②⑤④⑥ D.②③①⑤④⑥
除去溶液中过量的氢氧化钠和碳酸钠
(3)海水资源综合利用的部分途径如图2所示。①氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳的条件下,使碳酸氢钠结晶析出,该反应的化学方程式是__________________________________________;
NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl
相关课件
这是一份鲁教版 (五四制)九年级全册3 远离有毒物质习题ppt课件,共48页。PPT课件主要包含了答案呈现,CuOH2,KNO3,CO2,NaOH,Na2CO3,NaCl,复分解反应,酚酞试液,BaSO4等内容,欢迎下载使用。
这是一份2021学年第一单元 步入化学殿堂综合与测试说课课件ppt,共25页。PPT课件主要包含了答案呈现,降温结晶,冷却热饱和溶液,乙>甲>丙等内容,欢迎下载使用。
这是一份鲁教版九年级上册第一单元 步入化学殿堂综合与测试集体备课ppt课件,共17页。PPT课件主要包含了答案呈现,NaCl,③②①④等内容,欢迎下载使用。









