





初中化学第6章 溶解现象第1节 物质在水中的分散课堂教学课件ppt
展开
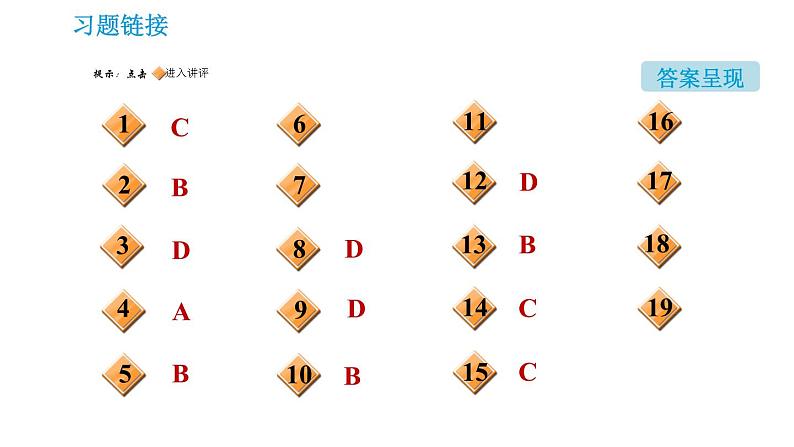
这是一份初中化学第6章 溶解现象第1节 物质在水中的分散课堂教学课件ppt,共51页。PPT课件主要包含了答案呈现,稀盐酸,澄清石灰水,澄清石灰水变浑浊,碳酸氢钠,纯碱或苏打,CaCO3,NaCl,NaHCO3,NaNO2等内容,欢迎下载使用。
1.下列关于食盐的叙述中,错误的是( )A.氯化钠是人体正常生理活动所必不可少的B.人体每天摄入适量的食盐来补充因出汗、排尿而排出的氯化钠C.人们每天都要消耗氯化钠,因此氯化钠的摄入越多越有利于身体健康D.氯化钠由Na+和Cl-构成
2.下列有关物质的化学式、名称、俗名不完全对应的是( ) A.NaHCO3、碳酸氢钠、小苏打B.CaO、氢氧化钙、生石灰C.Na2CO3、碳酸钠、纯碱D.NaCl、氯化钠、食盐
3.碳酸氢钠是生活中常见的盐,下列说法错误的是( )A.发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔B.干粉灭火器中含有碳酸氢钠,可用来扑灭油、气燃烧引起的火灾C.碳酸氢钠和柠檬酸、水等混合可制汽水D.碳酸氢钠不能用作治疗胃酸过多的药剂
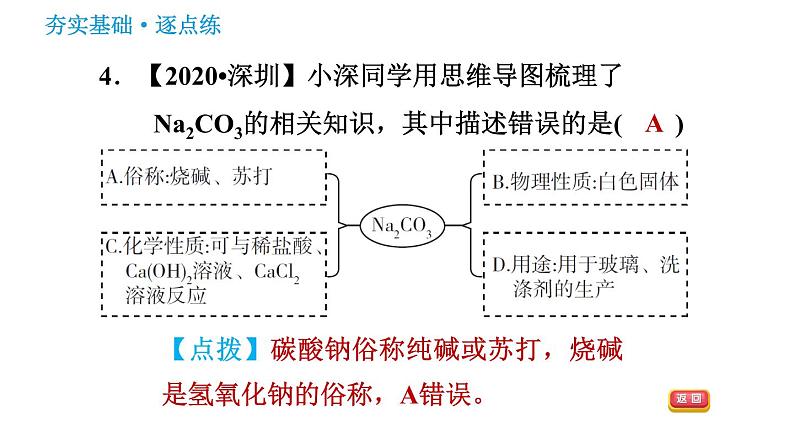
4.【2020•深圳】小深同学用思维导图梳理了Na2CO3的相关知识,其中描述错误的是( )
【点拨】碳酸钠俗称纯碱或苏打,烧碱是氢氧化钠的俗称,A错误。
5.下列关于碳酸钙的说法错误的是( ) A.大理石的主要成分是碳酸钙B.实验室常用碳酸钙与稀硫酸反应制取CO2C.碳酸钙可用作补钙剂D.石灰浆粉刷墙壁,“出汗”后变成碳酸钙
6.在前面我们已经学习了二氧化碳的实验室制法,其反应原理是____________________________________,碳酸钠和碳酸氢钠也能与盐酸发生类似的反应,请你试着写出这两种物质分别与盐酸反应的化学方程式:_____________________________________、_________________________________________;
CaCO3+2HCl===CaCl2+H2O+CO2↑
Na2CO3+2HCl===2NaCl+H2O+CO2↑
NaHCO3+HCl===NaCl+H2O+CO2↑
分析这三个反应你会发现它们有一些共同的特点,利用这种特点我们可以检验物质中是否含有碳酸根离子或碳酸氢根离子,具体方法是:向被检验的物质中加入____________,如果有气泡产生,将气体通入______________________中,如果观察到__________________________,就证明该物质中含有碳酸根离子或碳酸氢根离子。
7.小明在厨房里取了一种白色粉末A,带到化学实验室进行实验,结果如下图所示:
请回答下列问题:(1)若A由四种元素组成,则A的名称是____________,它与盐酸反应的化学方程式为___________________________________________。
(2)若A由三种元素组成,则A的俗名是______________,它与石灰水反应的化学方程式为___________________________________________。
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
(3)写出D→E的化学方程式:____________________________________。
CO2+Ca(OH)2===CaCO3↓+H2O
8.下列说法正确的是( )A.用亚硝酸钠烹调食物B.用食盐水除水垢C.为了给人体补钙,可以长期饮用硬水D.用硝酸铵制冰袋治疗高烧
【点拨】亚硝酸钠有毒,不能用来烹调食物。
9.下列对实验过程的评价正确的是( )A.某固体中加稀盐酸产生无色气体,证明该固体中一定含有CO2-3B.检验某固体中是否含有CO2-3,只需加入稀盐酸,有气泡产生,则一定是碳酸盐C.向无色溶液中滴加稀盐酸有气泡产生,则该溶液中一定含有CO2-3D.检验食盐中是否混有纯碱,可用取样加入稀盐酸的方法 ,
【点拨】能与稀盐酸反应产生气体的固体物质有碳酸盐和活泼金属,故A错误;检验CO2-3需用稀盐酸和澄清石灰水两种试剂,故B错误;能与稀盐酸反应产生气体的溶液,一定含有CO2-3或HCO-3,故C错误,检验食盐中是否混有纯碱,可取样滴加稀盐酸,若有气泡产生,证明样品中混有纯碱,若没有气泡产生,证明样品中不含纯碱。
10.【中考•齐齐哈尔】有关酸碱盐的说法错误的是( )A.工业上常用稀硫酸除铁锈B.水壶中的水垢常用食盐水来清洗C.炉具清洁剂中的氢氧化钠具有强烈的腐蚀性D.碳酸钠常用于玻璃、造纸、洗涤剂的生产
【方法规律】本题采用性质决定用途的思想方法解答。稀硫酸能与金属氧化物反应,因此可用于金属表面除锈;水垢的主要成分是CaCO3和Mg(OH)2,它们都不溶于水,但能溶于酸,因此可用稀盐酸或食醋除去水壶中的水垢,食盐水是不能除去水垢的;氢氧化钠能与油脂反应,因此可作炉具清洁剂,但氢氧化钠有强烈腐蚀性,使用时应十分小心;碳酸钠是一种重要的化工原料,广泛用于玻璃、造纸、洗涤剂的生产。
11.选择适当的盐的化学式填空:(1)常用作建筑材料的是________________。(2)常用作调味品的是__________________。(3)焙制糕点用到的发酵粉中含有的盐是____________。
(4)工业盐中含有的有毒物质是________________。(5)配制波尔多液用到的盐是__________________。(6)可用于玻璃、造纸、纺织、洗涤剂等工业的盐是_____________。
12.【中考•山西】某同学在家中找到一种白色粉末,带到学校实验室进行实验,实验过程与现象如下: 对此粉末成分判断正确的是( )
A.该粉末一定是碳酸钙B.该粉末中含有碳酸根离子,不可能含碳酸氢根离子C.该粉末一定是一种碱D.该粉末可能是碳酸钠或碳酸氢钠
【方法规律】本题采用现象分析法解答。首先由白色粉末加水溶解得无色溶液,说明白色粉末能溶于水,一定不是碳酸钙;滴加酚酞,溶液变红,说明溶液显碱性;加入稀盐酸,产生无色无味的气体,该气体能使澄清石灰水变浑浊,说明原白色粉末中一定含CO2-3或HCO-3。
13.除去氯化钠溶液中混有的少量碳酸钠,应选用适量的试剂是( )A.稀硫酸 B.稀盐酸C.澄清石灰水 D.硝酸银溶液
【方法规律】本题采用对照法解答。对照除杂的原则“不增”“不减”“易分”进行解答。要除去氯化钠中混有的少量碳酸钠,若选用稀硫酸,则稀硫酸与碳酸钠反应生成硫酸钠,除去了碳酸钠又引进了新杂质硫酸钠,违背了“不增”的原则;若用稀盐酸,则盐酸与碳酸钠反应,生成物为氯化钠,在除去杂质的同时,又增加被提纯物质的量,是较好的除杂方法;
若用澄清石灰水,则石灰水与碳酸钠反应,生成氢氧化钠,虽然除去了碳酸钠,但又引入了氢氧化钠,违背了除杂的原则;若用硝酸银溶液,则氯化钠、碳酸钠都能与硝酸银溶液反应,违背了“不减”的原则。
14.【中考•齐齐哈尔】某学习小组测定实验室里一瓶NaOH溶液是否变质,以及变质程度,进行了下列实验,实验方案正确的是( )A.取少量样品,加入几滴酚酞试液,溶液由无色变红色,证明氢氧化钠溶液没有变质B.取少量样品,加入少量稀盐酸,没有气泡产生,证明氢氧化钠溶液没有变质
C.取少量样品,加入过量的氯化钡溶液,有白色沉淀生成,过滤,向滤液中加入几滴酚酞试液,溶液不变色,证明氢氧化钠溶液完全变质D.取少量样品,加入过量的氢氧化钡溶液,有白色沉淀生成,过滤,向滤液中加入几滴酚酞试液,溶液由无色变红色,证明氢氧化钠溶液部分变质
【点拨】检验一瓶NaOH溶液是否变质实质是检验溶液中是否含CO2-3,由于Na2CO3溶液显碱性,因此不能用酚酞试液检验NaOH 溶液是否变质,故A错误;可以向样品中滴加稀盐酸,观察是否有气泡产生加以判断,但是所加稀盐酸必须足量,如果稀盐酸的量太少,则稀盐酸会先与未变质的NaOH反应而没有气泡产生,无法判断NaOH溶液是否变质,故B错误;
向样品中滴加过量的BaCl2溶液,若有白色沉淀生成,证明NaOH溶液一定变质,同时过量的BaCl2能将Na2CO3除去,再向溶液中滴加酚酞,若溶液不变色,证明没有NaOH存在,即NaOH溶液已完全变质,故C正确;若将BaCl2换成Ba(OH)2,则无法证明NaOH溶液是否部分变质,因为Ba(OH)2能与Na2CO3反应生成NaOH,故D错误。
15.【2020•湘西】能将硝酸银、碳酸钠、氯化钾三种溶液鉴别出来的试剂是( )A.铜丝 B.硝酸钠溶液C.稀盐酸 D.氢氧化钠溶液
16.【中考•湛江】牙膏中的摩擦剂碳酸钙可以用石灰石来制备,甲同学设计了一种实验方案:(1)过滤时玻璃棒的作用是________,过滤后发现滤液浑浊,应________________。
(2)写出步骤②的化学方程式:_______________________,该反应是________(填“放热”或“吸热”)反应。写出步骤③的化学方程式:_____________________________________________。乙同学设计了一种实验方案:
CaO+H2O===Ca(OH)2
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
(3)请你写出乙同学实验方案的一个优点:_________________________________。
【点拨】(1)过滤时玻璃棒的作用为引流,过滤后发现滤液仍浑浊,应重新过滤;(2)根据图中信息可以知道B为氧化钙,C为氢氧化钙,所以反应②为氧化钙和水的反应,该反应放出大量的热,反应③为氢氧化钙与碳酸钠的反应;(3)分析乙同学的方案可以知道,该方案无需加热,操作简单、节约能源。
17.A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物已略去):(1)A物质的化学式是________,B物质的俗称是________________,C物质的化学名称是_________。
(2)向A的块状固体上滴加水,观察到产生大量的水蒸气,该现象说明___________________________。(3)举出B物质在农业生产中的一种用途:_________________________________________。
(4)反应②的化学方程式为______________________________________,该反应可以用来检验二氧化碳气体,实验现象是___________________。
Ca(OH)2+CO2===CaCO3↓+H2O
(5)反应③的基本反应类型是____________,该反应前后碳元素的化合价________(填“改变”或“不改变”)。
【点拨】由于A、B、C均是含钙化合物,故应为初中化学中常见的氧化钙、碳酸钙、氢氧化钙等;结合图示可知,A能与水反应生成B,故A为氧化钙,B为氢氧化钙;又B(氢氧化钙)能与二氧化碳反应生成C,故C为碳酸钙;根据图示的其他途径验证:C(碳酸钙)能在高温下分解生成A(氧化钙)和二氧化碳;B(氢氧化钙)能与碳酸钠反应生成C(碳酸钙)和氢氧化钠。
18.【中考•汕尾】Na2CO3、NaHCO3是生活中常见的盐,某实验小组通过以下实验来探究这两种物质的性质(已知:Na2CO3、NaHCO3的水溶液均呈碱性;NaHCO3受热易分解生成Na2CO3、H2O和CO2)。
(1)称取两种固体各1 g分别放入两支试管中,再各加入5 mL水,振荡。固体充分溶解,并恢复至室温。①发现Na2CO3完全溶解,而NaHCO3有剩余。由此得出结论:在室温下,____________________________。②向所得溶液中各滴入1~2滴酚酞试液后,溶液均显________色。
碳酸钠的溶解度比碳酸氢钠的大
(2)①取少量NaHCO3按右图装置进行实验。可观察到的现象是:大试管口有水珠生成,____________________________;②用________的方法除去混在Na2CO3粉末中少量的NaHCO3。
(3)测定Na2CO3样品(含NaCl杂质)中Na2CO3的质量分数:①称取m g样品放入烧杯中加水溶解;②加入过量的CaCl2溶液充分反应,反应的化学方程式为____________________________________;证明反应后CaCl2有剩余的方法是_________________________________________________________________;③过滤、洗涤、干燥,称量沉淀的质量为n g。则样品中Na2CO3的质量分数为____________。
CaCl2+Na2CO3===CaCO3↓+2NaCl
加入碳酸钠,有沉淀生成
【点拨】(1)①相同条件下,一定量水中溶解的溶质越多,溶解度越大;②碳酸钠和碳酸氢钠的溶液都呈碱性,都能使无色酚酞试液变红;(2)①碳酸氢钠受热易分解,生成碳酸钠、二氧化碳、水,二氧化碳能使澄清的石灰水变浑浊;②由于碳酸氢钠受热分解生成碳酸钠,因此可用加热的方法除去碳酸钠中混有的碳酸氢钠;
(3)②Ca2+能与CO2-3结合生成CaCO3沉淀,可向反应后所得溶液中加入碳酸钠,若有沉淀生成,说明氯化钙过量;③利用化学方程式CaCl2+Na2CO3 ===CaCO3↓+2NaCl,根据碳酸钙沉淀的质量为n g,可以求出样品中碳酸钠的质量为106n/100g,从而计算出样品中碳酸钠的质量分数为106n/m%。
19.【中考•盐城】厨房中有一包无标识的白色粉末,经初步认定可能是氯化钠、碳酸钠、碳酸氢钠中的一种。小明对白色粉末的成分进行了探究。【查阅资料】碳酸钠俗称________、苏打,碳酸氢钠俗称小苏打,两者都属于________(填“酸”“碱”或“盐”),都能溶于水,且水溶液都呈碱性。【实验探究】小明取适量白色粉末,配制成溶液,按表中所示实验方案进行探究。
(1)请完成表中空格。(2)实验步骤2中可能发生的反应的化学方程式为________________________________________________________________________________________ (写出一个即可)。实验步骤3中白色沉淀的成分是________________(填写化学式)。
Na2CO3+2HCl===2NaCl+H2O+CO2↑(或NaHCO3+HCl===NaCl+H2O+CO2↑)
【实验反思】小明实验后发现上述实验方案并不能确定白色粉末的组成。经老师指导后,小明再取少量配制的溶液滴加氯化钙溶液,没有观察到明显现象,则该白色粉末是_______________。
相关课件
这是一份2020-2021学年第8章 食品中的有机化合物第2节 糖类 油脂背景图课件ppt,共17页。PPT课件主要包含了答案呈现,花生油减慢,见习题,答案D,花生油,碳原子个数,CO2或H2O,H2O或CO2,C6H12O6等内容,欢迎下载使用。
这是一份初中化学沪教版九年级下册第6章 溶解现象第1节 物质在水中的分散说课ppt课件,共27页。PPT课件主要包含了答案呈现,见习题,答案A,答案D,答案B,答案C等内容,欢迎下载使用。
这是一份初中化学科粤版九年级下册7.3 溶液浓稀的表示教课ppt课件,共25页。PPT课件主要包含了答案呈现,②①⑤③④,凹液面的最低处,托盘天平,称取氯化钠,加速氯化钠的溶解等内容,欢迎下载使用。










