新教材2022届新高考化学人教版一轮课时作业:30 物质的分离、提纯、检验与鉴别
展开这是一份新教材2022届新高考化学人教版一轮课时作业:30 物质的分离、提纯、检验与鉴别,共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
一、选择题
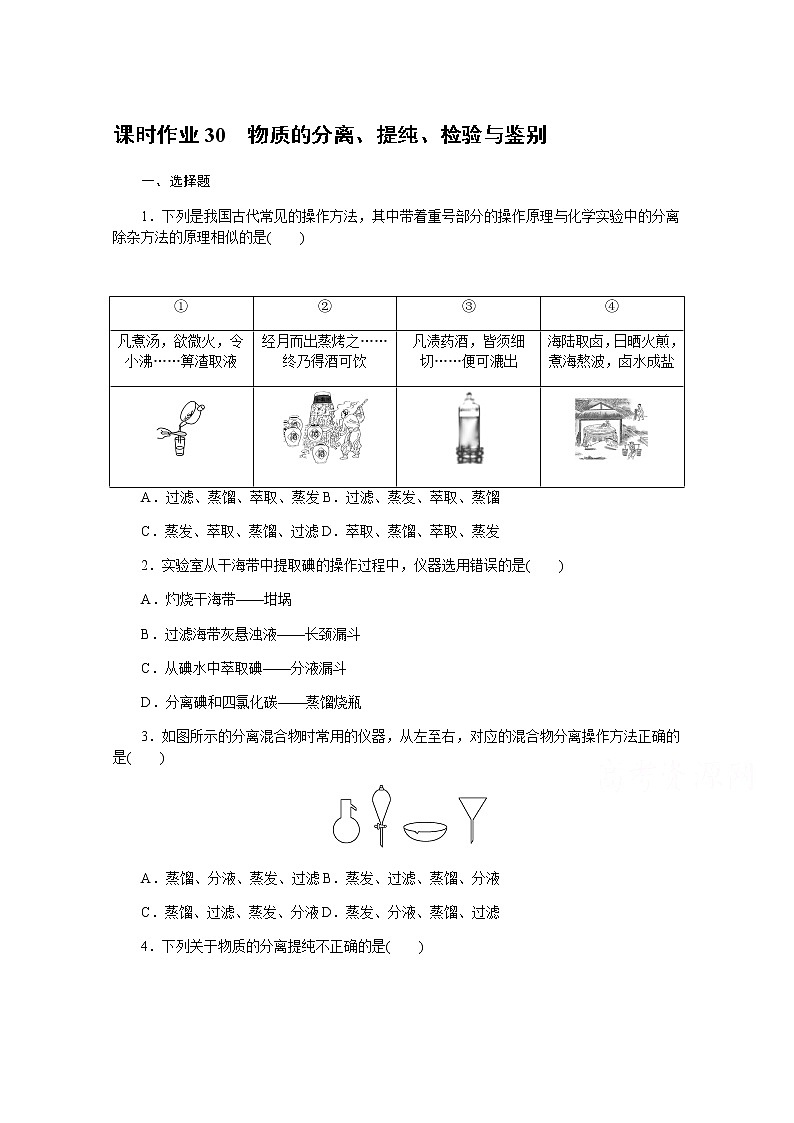
1.下列是我国古代常见的操作方法,其中带着重号部分的操作原理与化学实验中的分离除杂方法的原理相似的是( )
A.过滤、蒸馏、萃取、蒸发B.过滤、蒸发、萃取、蒸馏
C.蒸发、萃取、蒸馏、过滤D.萃取、蒸馏、萃取、蒸发
2.实验室从干海带中提取碘的操作过程中,仪器选用错误的是( )
A.灼烧干海带——坩埚
B.过滤海带灰悬浊液——长颈漏斗
C.从碘水中萃取碘——分液漏斗
D.分离碘和四氯化碳——蒸馏烧瓶
3.如图所示的分离混合物时常用的仪器,从左至右,对应的混合物分离操作方法正确的是( )
A.蒸馏、分液、蒸发、过滤B.蒸发、过滤、蒸馏、分液
C.蒸馏、过滤、蒸发、分液D.蒸发、分液、蒸馏、过滤
4.下列关于物质的分离提纯不正确的是( )
图1 图2
A.用如图1所示装置分离CCl4和水
B.除去苯中的少量苯酚,加入适量浓溴水,过滤
C.实验室用如图2所示装置除去Cl2中的少量HCl
D.除去O2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
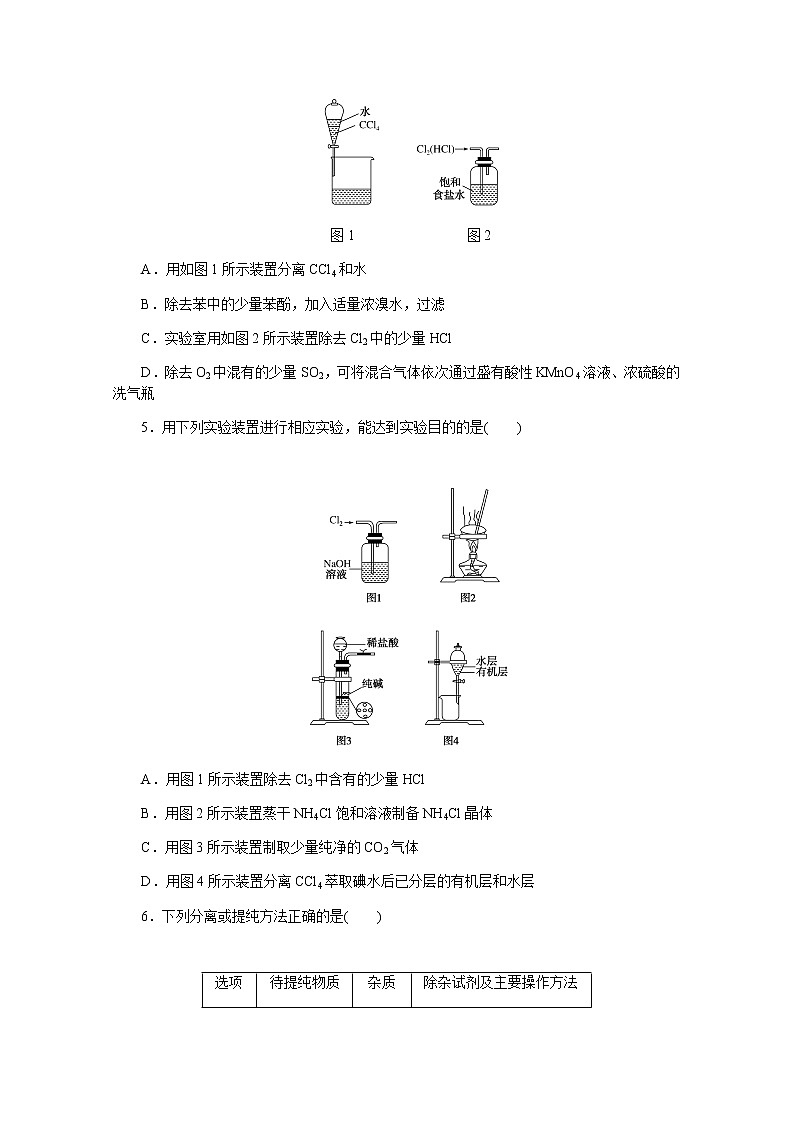
5.用下列实验装置进行相应实验,能达到实验目的的是( )
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
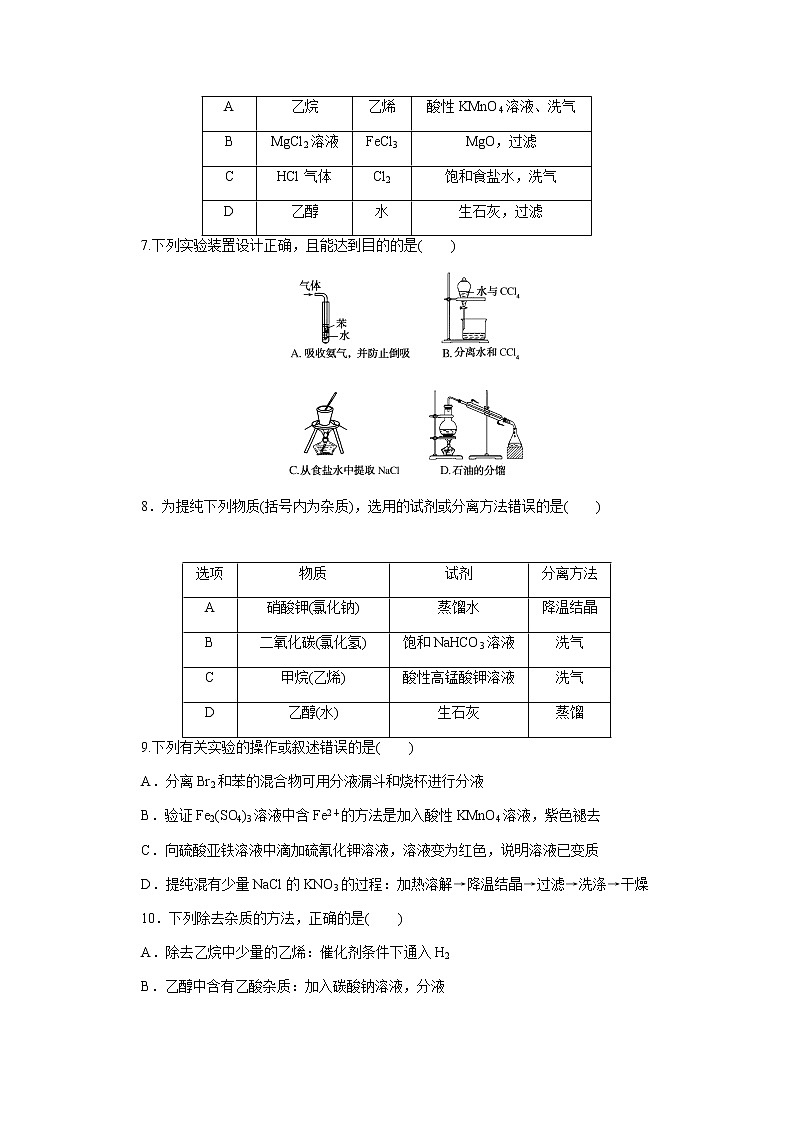
6.下列分离或提纯方法正确的是( )
7.下列实验装置设计正确,且能达到目的的是( )
8.为提纯下列物质(括号内为杂质),选用的试剂或分离方法错误的是( )
9.下列有关实验的操作或叙述错误的是( )
A.分离Br2和苯的混合物可用分液漏斗和烧杯进行分液
B.验证Fe2(SO4)3溶液中含Fe2+的方法是加入酸性KMnO4溶液,紫色褪去
C.向硫酸亚铁溶液中滴加硫氰化钾溶液,溶液变为红色,说明溶液已变质
D.提纯混有少量NaCl的KNO3的过程:加热溶解→降温结晶→过滤→洗涤→干燥
10.下列除去杂质的方法,正确的是( )
A.除去乙烷中少量的乙烯:催化剂条件下通入H2
B.乙醇中含有乙酸杂质:加入碳酸钠溶液,分液
C.FeCl3溶液中含有CuCl2杂质:加入过量铁粉,过滤
D.CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气
11.实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示。下列分析正确的是( )
A.操作Ⅰ是过滤,将固体分离除去
B.操作Ⅱ是加热浓缩。趁热过滤,除去杂质氯化钠
C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来
D.操作Ⅰ~Ⅲ总共需两次过滤
12.某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
下列试剂或操作不合理的是( )
A.试剂①为Ba(OH)2溶液
B.操作②为结晶
C.操作③为过滤
D.试剂④为稀HNO3
二、非选择题
13.硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是________________________________________________________,原料中的金属钠通常保存在__________中,实验室取用少量金属钠需要用到的实验用品有________、________、玻璃片和小刀等。
(2)第②步分离采用的方法是________;第③步分离(NaBH4)并回收溶剂,采用的方法是________。
14.工业生产需要大量原料,消耗大量能源,在得到所需产品的同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如图实验方案:
(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是________。设计简单实验检验绿矾是否变质,简述你的操作:________________________________________________________________________
________________________________________________________________________。
(2)步骤Ⅰ中加入过量铁粉的目的是______________________________________________________,步骤Ⅱ中________(填“能”或“不能”)用盐酸代替硫酸。
(3)步骤V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉,过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。从安全角度考虑,方案________不好;从产品纯度考虑,方案________不好。
(4)写出步骤Ⅱ中涉及反应的离子方程式:________________________________________________________________________
________________________________________________________________________;
步骤Ⅳ得到绿矾的操作是蒸发浓缩、__________、__________。
课时作业30 物质的分离、提纯、检验与鉴别
1.解析:①中的箅渣取液,是用细网将固液混合物中的固体和液体分开,其原理与过滤的原理相似;②中通过蒸烤造酒,是通过加热的方法将酒精等物质从混合液中分离出来,其原理与蒸馏的原理相似;③中通过浸泡,使草药中的有效成分溶于酒中,其原理与萃取的原理相似;④中的日晒火煎,卤水成盐,是通过日晒的方法,将水分蒸发得到食盐,其原理与蒸发的原理相似。
答案:A
2.解析:灼烧固体应在坩埚中进行,所以灼烧干海带用到坩埚,故A正确;过滤煮沸后的海带灰悬浊液要用普通漏斗,不用长颈漏斗,故B错误;从碘水中萃取碘,可用四氯化碳、苯等,碘在四氯化碳、苯等中的溶解度大于在水中的溶解度,会发生萃取现象出现分层,可以用分液漏斗进行分液,故C正确;碘易溶于四氯化碳,四氯化碳易挥发,采用蒸馏的操作分离,所以分离碘和四氯化碳用到蒸馏烧瓶,故D正确。
答案:B
3.解析:由图可知,仪器分别为蒸馏烧瓶、分液漏斗、蒸发皿、普通漏斗。蒸馏烧瓶用于蒸馏操作;分液漏斗用于分液操作;蒸发皿用于蒸发操作;普通漏斗用于过滤操作。
答案:A
4.解析:A项,CCl4与水分层,故可以用分液法分离,正确;B项,生成的三溴苯酚与苯互溶,溴也易溶于苯中,错误;C项,Cl2在饱和食盐水中溶解度很小,而HCl极易溶于水,正确;D项,利用SO2的还原性,用酸性KMnO4溶液除去,再用浓硫酸干燥O2,正确。
答案:B
5.解析:A项,Cl2也能与NaOH溶液反应,故不能用NaOH溶液除去Cl2中含有的少量HCl;B项,NH4Cl晶体受热易分解,故不能通过蒸干NH4Cl饱和溶液的方法制备NH4Cl晶体;C项,纯碱易溶于水,利用图示装置不能达到使反应随时发生或停止的目的;D项,碘在CCl4中的溶解度远大于在水中的溶解度,且CCl4与水不相溶,密度大于水的密度,故可用图中所示装置分离CCl4萃取碘水后已分层的有机层和水层。
答案:D
6.解析:酸性KMnO4溶液能将乙烯氧化,但除去乙烯的同时会引入CO2,A项错误;除去MgCl2溶液中的FeCl3,加入MgO后,促进Fe3+水解,Fe3+转化为Fe(OH)3,过滤后可得MgCl2溶液,B项正确;HCl易溶于饱和食盐水,而Cl2不易溶于饱和食盐水,故C项错误;除去乙醇中的水,加入生石灰,然后进行蒸馏,D项错误。
答案:B
7.解析:A项,导管插入水中,不能防止倒吸;C项,不能用坩埚从溶液中提取溶质;D项,没有温度计,不能用于分馏。
答案:B
8.解析:KNO3的溶解度受温度影响较大,而NaCl的溶解度受温度影响较小,可加蒸馏水溶解固体,再通过蒸发浓缩、降温结晶的方法,获得纯净的KNO3固体,A项正确;HCl与饱和NaHCO3溶液反应生成二氧化碳,B项正确;乙烯被酸性KMnO4氧化生成CO2,使甲烷中混入CO2气体,C项错误;加入的生石灰能与水反应生成Ca(OH)2,消耗掉部分水,再通过蒸馏获得乙醇,D项正确。
答案:C
9.解析:Br2与苯互溶不分层。
答案:A
10.解析:通入氢气过少无法除净乙烯,通入氢气过量会引入杂质氢气,A项错误;乙醇和乙酸钠都溶于水,不能分层,不能用分液法进行分离,B项错误;加入过量铁粉,发生反应:Fe+Cu2+===Fe2++Cu,2Fe3++Fe===3Fe2+,C项错误;碳酸氢钠与HCl反应放出CO2,而CO2不与饱和碳酸氢钠溶液反应,D项正确。
答案:D
11.解析:KNO3中混有少量NaCl应提纯KNO3,将它们都溶于水,并降温结晶。因为KNO3的溶解度随温度的升高而升高,NaCl的溶解度随温度的升高而基本无明显变化。则有,操作Ⅰ是在烧杯中加水溶解,操作Ⅱ是蒸发浓缩,得到较高温度下的KNO3饱和溶液,操作Ⅲ为冷却结晶,利用溶解度差异使KNO3结晶析出,过滤,洗涤,干燥即得KNO3晶体。故选C。
答案:C
12.解析:根据题意,可用Ba(OH)2溶液除去SOeq \\al(2-,4)、NHeq \\al(+,4)和HCOeq \\al(-,3),NH3·H2O通过加热除去,操作②为加热;过量的Ba2+用Na2CO3溶液除去,过滤除去沉淀,滤液中过量的OH-和COeq \\al(2-,3)用硝酸除去,则操作③为过滤,试剂④为稀HNO3。
答案:B
13.解析:(1)Na能与空气中的水蒸气、氧气反应,NaBH4常温下能与水反应,因而通入氩气是为了排除干扰因素空气和水,取用钠时,用镊子夹取,用滤纸吸干表面的煤油。(2)从流程可看出第②步是固体与液体的分离,其操作为过滤。根据已知信息可知NaBH4可溶于异丙酸,且异丙酸的沸点较低(33℃),回收异丙酸可选用蒸馏的方法。
答案:(1)排尽装置中的空气和水蒸气 煤油 镊子 滤纸
(2)过滤 蒸馏
14.解析:(1)滤液中硫酸亚铁的浓度较低,先蒸发水到热饱和溶液,然后降温结晶,最后过滤得到硫酸亚铁晶体,过滤还需要漏斗;绿矾变质生成+3价铁,检验Fe3+用硫氰化钾溶液,即取少量晶体溶于水,滴加硫氰化钾溶液,若溶液变红色,说明绿矾已变质。(2)加入过量的铁粉,将Cu2+和Hg2+全部转化成相应单质得到铜和汞;若用稀盐酸代替稀硫酸,制得的绿矾中会混有氯化亚铁杂质。(3)氢气和一氧化碳易燃烧,且一氧化碳有毒,用二者还原氧化铜存在不安全因素,即易发生爆炸,所以从安全方面考虑甲、乙不好;用炭粉还原氧化铜,所得铜中易混有炭粉,即从纯度方面考虑,丙不好。(4)根据框图知滤渣成分为Cu、Fe、Hg,步骤Ⅱ加入稀硫酸只有Fe能与酸反应,所以反应的离子方程式为2H++Fe===Fe2++H2↑。步骤Ⅳ是由硫酸亚铁溶液得到绿矾的操作,需要经过蒸发浓缩,冷却结晶和过滤即可。
答案:(1)漏斗 取少量晶体溶于水,加入KSCN溶液,如溶液变红色,则产品变质
(2)将Cu2+、Hg2+全部置换出来 不能
(3)甲、乙 丙
(4)Fe+2H+===Fe2++H2↑ 冷却结晶 过滤①
②
③
④
凡煮汤,欲微火,令小沸……箅渣取液
经月而出蒸烤之……终乃得酒可饮
凡渍药酒,皆须细切……便可漉出
海陆取卤,日晒火煎,煮海熬波,卤水成盐
选项
待提纯物质
杂质
除杂试剂及主要操作方法
A
乙烷
乙烯
酸性KMnO4溶液、洗气
B
MgCl2溶液
FeCl3
MgO,过滤
C
HCl气体
Cl2
饱和食盐水,洗气
D
乙醇
水
生石灰,过滤
选项
物质
试剂
分离方法
A
硝酸钾(氯化钠)
蒸馏水
降温结晶
B
二氧化碳(氯化氢)
饱和NaHCO3溶液
洗气
C
甲烷(乙烯)
酸性高锰酸钾溶液
洗气
D
乙醇(水)
生石灰
蒸馏
选择试剂
①
Na2CO3溶液
④
实验操作
②
③
加热
相关试卷
这是一份2024届人教版高考化学一轮复习课练28物质的分离、提纯、检验与鉴别作业含答案,共17页。试卷主要包含了下列除去括号内杂质方法正确的是等内容,欢迎下载使用。
这是一份2024版新教材高考化学复习特训卷课练28物质的分离提纯检验与鉴别,共12页。试卷主要包含了下列除去括号内杂质方法正确的是等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习课时作业30物质的分离提纯检验与鉴别含答案












