

新教材2022届新高考化学人教版一轮学案:微专题·大素养 9 化学实验中的含氮化合物探究题
展开化学实验中的含氮化合物探究题
一、围绕氨的性质与制法展开的探究
[例1] 某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。
(1)装置A中烧瓶内试剂可选用 (填序号)。
a.碱石灰 b.浓硫酸
c.生石灰 d.五氧化二磷
e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的 装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是
________________________________________________________________________
________________________________________________________________________。
(3)若探究氨气的还原性,需打开K1、K3,K2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成气体必须通过盛有 试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为________________________________________________________________________
________________________________________________________________________;
③从K3处导管逸出的气体中含有少量Cl2,则C装置中应盛放 溶液(填化学式),反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
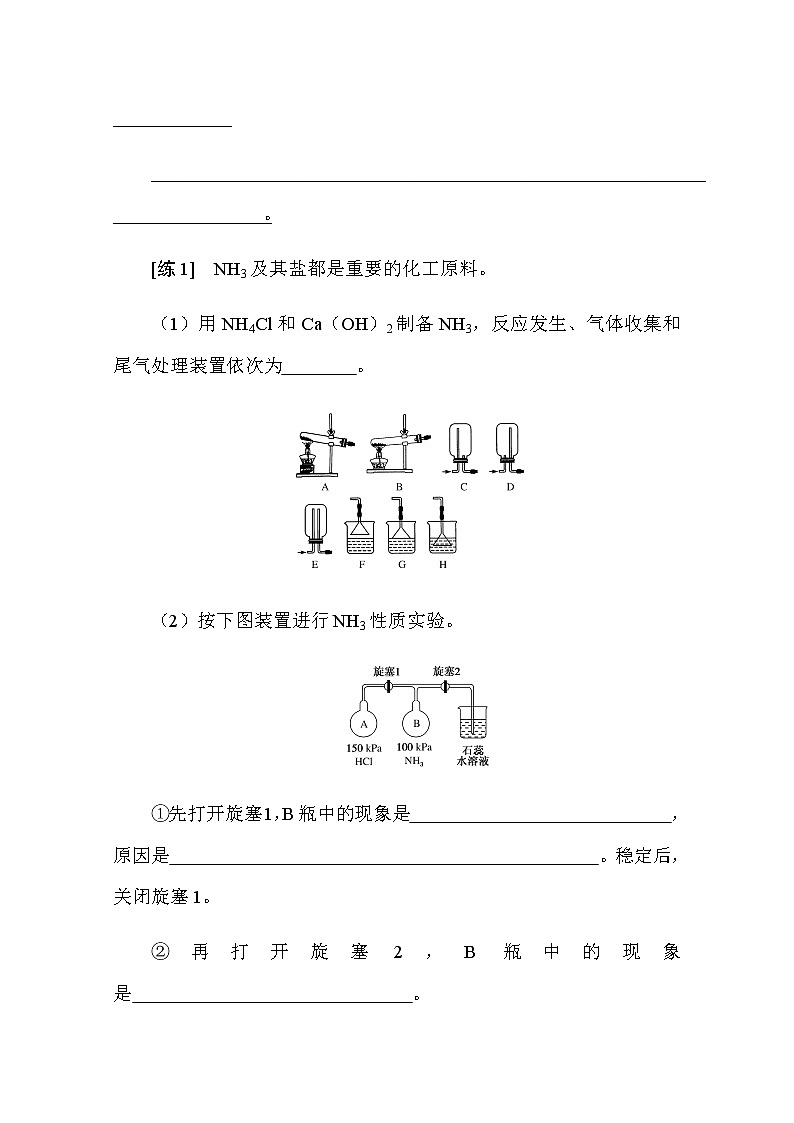
[练1] NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 。
(2)按下图装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是 ,原因是 。稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是 。
[练2] 干燥的二氧化碳和氨气反应可生成氨基甲酸铵固体,化学方程式为:2NH3(g)+CO2(g)⇌NH2COONH4(s) ΔH<0,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为 ;装置2中所加试剂为________________________________________________________________________。
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________;
试管口不能向上倾斜的原因是________________________________________________________________________
________________________________________________________________________。
装置3中试剂为KOH,其作用为________________________________________________________________________
________________________________________________________________________。
(3)反应时三颈烧瓶需用冷水浴冷却,其目的是________________________________________________________________________
________________________________________________________________________。
二、围绕硝酸与氮氧化物展开的探究
[例2] 用如图所示装置制备、收集二氧化氮气体,并探究其性质。
(1)装置A中的分液漏斗中盛装的液体是 ,烧瓶中预先加入的是铜屑,铁的价格比铜的价格低,此处用铜不用铁的原因是________________________________________________________________________。
(2)干燥管B中盛装的干燥剂可以是________________________________________________________________________
(选填“浓硫酸”“无水氯化钙”“五氧化二磷”“碱石灰”),干燥管D中干燥剂的作用是________________________________________________________________________
________________________________________________________________________。
(3)装置E的作用是吸收尾气,吸收过程中发生反应的化学方程式如下,请将其补充完整。
eq \x( ) NaOH+ eq \x( ) NO2=== + eq \x( ) NaNO2+ eq \x( ) H2O。
(4)用上述装置收集NO气体,采用的收集装置是________________________________________________________________________
(选填“F”或“G”)。
[练3] 亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O;
②气体液化的温度:NO2为21 ℃,NO为-152 ℃。
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、 、 、 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________________________________________________________________
________________________________________________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________________________________________________________
________________________________________________________________________。
②装置E的作用是________________________________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________________________________________________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是________________________________________________________________________。
[练4] 亚硝酰氯(NOCl)是有机合成中重要试剂,可由NO与Cl2在常温常压(或稍低温度)下合成,其熔点-64.5℃,沸点-5.5℃,遇水易水解。实验室模拟制备装置如图所示(部分夹持装置省略),D中三颈烧瓶置于-10℃冰盐水中。
经查阅资料:NO与NaOH溶液不反应,但NO2+NO+2NaOH===2NaNO2+H2O。
(1)仪器甲的名称是 。
(2)图示装置中恒压漏斗与分液漏斗相比,其优点为________________________________________________________________________
________________________________________________________________________。
(3)实验开始时。先打开K1、K2,关闭K3,打开分液漏斗活塞滴入适量稀硝酸,至C中红棕色完全消失后,关闭K1、K2,此时装置C的作用为________________________________________________________________________。
滴入适量浓盐酸,点燃酒精灯,当 (填装置字母)中充满黄绿色气体时,打开K1、K3,制备NOCl。
(4)装置乙中装有无水CaCl2,其作用为 ;丙为尾气处理装置,则最佳选择为 。
微专题·大素养9
[例1] 解析:解答本题要注意以下4点:①实验室中快速制备氨气的方法和原理;②氨气的“喷泉实验”原理和操作;③氯气的实验室制法和尾气吸收;④氨气和氯气的反应原理。
(1)在浓氨水中存在平衡:NH3+H2O⇌NH3·H2O⇌NH4++OH-,加入生石灰[CaO+H2O===Ca(OH)2]或NaOH固体,平衡左移,同时放出大量的热促进氨水的挥发。碱石灰的成分是烧碱和生石灰,能快速制备氨气。
(2)氨气极易溶于水,不溶于CCl4,要用防倒吸装置,因此选择Ⅱ或Ⅲ。要使装置D发生喷泉现象,必须使烧瓶中的压强迅速降低,形成内外压强差。用热毛巾将烧瓶捂热,可使D中氨气受热膨胀,赶出导管中空气后与水接触,D中压强变小即产生“喷泉”。
(3)①用二氧化锰与浓盐酸制取的氯气中,混有氯化氢气体和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气。②探究氨气具有还原性,氯气与氨气反应产生白烟,联系NH3+HCl===NH4Cl可知,“白烟”的成分为氯化铵,氯元素化合价降低,则生成的“无色无味气体”必为氨气的氧化产物,可推知为氮气。③氯气是有毒气体,可与强碱溶液反应,因此可用氢氧化钠溶液进行尾气吸收。
答案:(1)ace
(2)Ⅱ或Ⅲ 用热毛巾将烧瓶捂热片刻(其他合理答案均可)
(3)①饱和食盐水、浓硫酸
②3Cl2+8NH3===6NH4Cl+N2
③NaOH Cl2+2OH-===Cl-+ClO-+H2O
[练1] 答案:(1)A、C、G
(2)①有白烟生成 A瓶中的氯化氢扩散到B瓶中,与B瓶中的氨气反应生成氯化铵,能看到白烟 ②液体进入B瓶中,溶液的颜色变红
[练2] 答案:(1)稀盐酸 浓H2SO4
(2)2NH4Cl+Ca(OH)2≜2NH3↑+2H2O+CaCl2 防止冷凝水倒流到试管底部使试管破裂 干燥剂(干燥氨气)
(3)降低温度,使平衡正向移动提高产量
[例2] 解析:(1)铁在浓硝酸中钝化,故使用铜屑与浓硝酸反应制备二氧化氮。
(3)根据提供的反应物,NaOH中各元素化合价不可能发生变化,而NO2中N的化合价由+4价降低为产物NaNO2中的+3价,则另外一种产物含有N,且N的化合价升高为+5价,该物质是NaNO3,根据氧化还原反应方程式的配平方法可以配平该化学方程式。
答案:(1)浓硝酸 铁在浓硝酸中会钝化而终止反应
(2)无水氯化钙或五氧化二磷 防止E装置中的水蒸气进入集气瓶
(3)2 2 NaNO3 1 1 (4)G
[练3] 解析:(1)根据NO、NO2的液化温度和性质可知装置D用于检验NO,装置E用于检验并分离NO2,装置B为尾气处理装置,NO2会干扰NO的检验,所以为了检验装置A中的气体产物,仪器的连接顺序是A、C、E、D、B。
(2)由于NO极易被空气中的氧气氧化为NO2,所以先通入一段时间氮气,排除装置中的空气,防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰。
(3)①利用装置D检验NO。开始时装置D中无色,通入氧气后出现红棕色气体即可证明NO的存在。②装置E的作用是降温冷凝,使NO2完全液化,避免干扰NO的检验。
(4)因为NO2、O2和水共同作用可以产生HNO3,所以装置B中发生反应的化学方程式为4NO2+O2+4NaOH===4NaNO3+2H2O。
(5)装置A中发生反应的化学方程式是2NaNO2+H2SO4===Na2SO4+NO2↑+NO↑+H2O。
答案:(1)E D B
(2)防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰
(3)①装置D中通入氧气后出现红棕色气体
②冷凝,使NO2完全液化
(4)4NO2+O2+4NaOH===4NaNO3+2H2O
(5)2NaNO2+H2SO4===Na2SO4+NO2↑+NO↑+H2O
[练4] 解析:(3)关闭K1、K2,A中依然产生NO气体,故此时C可以作为安全瓶,储存A中产生的NO气体,滴入适量浓盐酸,点燃酒精灯,当D中充满黄绿色气体时,打开K1、K3,制备NOCl。(4)亚硝酰氯(NOCl)遇水发生水解反应,装置乙中无水氯化钙可以吸收水蒸气,防止水蒸气进入D中使NOCl水解,丙为尾气处理装置,尾气主要为NO、Cl2和NOCl、NO2,故在尾气吸收时可以选用NaOH溶液,同时为了防止NOCl和NO2挥发逸出,可以在上方加一个浸有NaOH溶液的棉花团,①中碱石灰固体不能吸收NOCl和NO气体,③中不能避免挥发出来的气体污染空气,则最佳选择为②。
答案:(1)蒸馏烧瓶
(2)平衡压强,便于液体顺利流下
(3)储存A中产生的NO D
(4)防止水蒸气进入D,使NOCl水解 ②
备选装置(其中水中含酚酞试液)
Ⅰ
Ⅱ
Ⅲ
新教材2022届新高考化学人教版一轮学案:微专题·大素养 4 离子共存与推断: 这是一份新教材2022届新高考化学人教版一轮学案:微专题·大素养 4 离子共存与推断,共12页。学案主要包含了知识基础,素养专练,练后归纳等内容,欢迎下载使用。
新教材2022届新高考化学人教版一轮学案:微专题·大素养 2 化学计算中的快捷解题方法: 这是一份新教材2022届新高考化学人教版一轮学案:微专题·大素养 2 化学计算中的快捷解题方法,共13页。学案主要包含了守恒法),差量法),关系式法),极限假设法)等内容,欢迎下载使用。
新教材2022届新高考化学人教版一轮学案:微专题·大素养 17 化学实验题中基本操作的答题规范: 这是一份新教材2022届新高考化学人教版一轮学案:微专题·大素养 17 化学实验题中基本操作的答题规范,共6页。












