





高中化学苏教版 (2019)必修 第二册专题6 化学反应与能量变化第二单元 化学反应中的热课文ppt课件
展开一、化学反应中的能量变化
研究发现,化学反应必然伴随着能量的变化。
1.放热反应与吸热反应
放热反应:有热量放出的化学反应。
吸热反应:有吸收热量的化学反应。
一个反应,若其正向进行时放热,则其逆向进行时必然吸热。反之亦然。
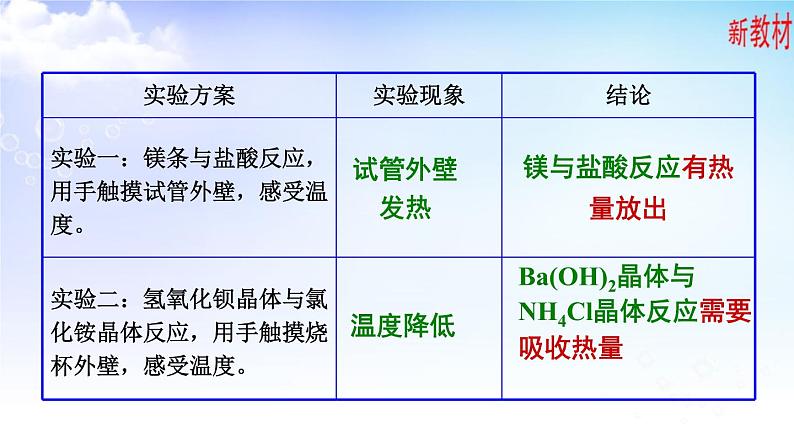
Ba(OH)2晶体与NH4Cl晶体反应需要吸收热量
镁与盐酸反应有热量放出
放热反应:(1)所有燃烧反应;(2)酸碱中和反应;(3)金属与酸生成气体的反应;(4)大多数的化合反应。 另:硫酸溶解等过程也有放热现象
2.常见的放热、吸热反应:
吸热反应: (1)大多数分解反应。(2)C+CO2 2CO(3)C+H2O(g) CO+H2(4) 氢氧化钡(或氢氧化钙)与氯化铵的反应。 另: 硝酸铵溶解等过程也有吸热现象
思考:是否吸热反应一定需要加热,而放热反应一定不需要加热呢?
需加热的反应不一定是吸热反应,要持续加热的反应才是吸热反应。很多放热反应都需要加热才能进行。
如何用化学用语表示放热反应和吸热反应?
1.定义:表示反应所放出或吸收的热量多少的化学方程式,叫做热化学方程式。 H2(g)+Cl2(g) = 2HCl(g) △H=-184.6 kJ·ml-1
(1) 定义:在化学反应中放出或吸收的热量(2) 符号:△H (3) 单位:kJ·ml-1(4) △H>0----吸热反应;△H<0----放热反应
3.书写热化学方程式的注意事项:
(1) 要注明反应物和生成物的状态。 (g: 气体、l: 液体、s:固体、aq:溶液)
(2) 同种物质在不同的状态下的热效应是不同的。 固态 → 液态 → 气态
2H2(g) + O2(g) = 2H2O(g) △H = -483.6 kJ·ml-12H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ·ml-1
(4)化学计量数可以是整数,也可以是小数或分数,且只能表示物质的量,不能表示分子个数。
H2(g)+ O2(g) = H2O(l) △H = -285.8 kJ/ml-1
表示:1 ml 气态H2和0.5 ml气态 O2反应生成1 ml液态水时放出的热量为285.8 kJ。
(3)△H表示反应热,“-”表示放热,“+”表示吸热。 单位一般采用kJ·ml-1。
(6)注明反应的温度和压强。 (不注明的通常指101kPa和25℃)
(5) 化学计量数与 △H 之间存在正比关系。 反应热要与化学计量数一致。
H2(g)+ O2(g) = H2O(l) △H=-285.8 kJ·ml-1
2H2(g)+O2(g) = 2H2O(l)
△H=-571.6 kJ·ml-1
三、化学反应中能量变化的原因
2HF(g)=H2(g)+F2(g)
△H=270 kJ·ml-1
根据能量示意图判断反应吸放热,并且书写热反应方程式
断开化学键,需要吸收能量,形成化学键,需要放出能量 。
吸收总能量679.1 kJ
共放出总能量863.6 kJ
结论:1ml H2与1ml Cl2反应生成2ml HCl时, 放出184.5kJ的热量
N2(g)+3H2(g) =2NH3(g)
△H=-92 kJ·ml-1
1.化学键的断裂和生成是化学反应中能量变化的根本原因。 2.断裂旧化学键吸收的能量高于形成新化学键放出的能量,化学反应为吸热反应;反之,化学反应为为放热反应。 3.△H=反应物键能之和—生成物键能之和。
在原始社会,人类过的是茹毛饮血的生活,在发现了火之后,人类以草木为燃料,利用燃烧放出热量从事各项活动,人类的生活才逐步走向文明。人类社会在使用能源的方面经历了哪些阶段?
四、燃料的燃烧释放的能量
1.化石能源 煤、石油、天然气
2.热值:指在一定条件下单位质量的物质完全燃烧所放出的热量。单位:kJ·g-1
3.提高燃料的使用效率
(1)化石燃料存在的问题
①化石燃料燃烧伴随有毒有害物质排放,污染空气
(2)解决化石燃料燃烧问题的研究方向
①节约现有能源,减少化石能源的开采和使用
②提高燃料的使用效率,通过化学方法将化石燃料转化为洁净燃料,如煤的气化、液化等。
②燃烧产物是水,不污染环境,是一种洁净能源
③密度小、熔点低、难液化,贮存液氢的容器要求高。
1.(2012•常州高一检测)下列变化中属于吸热反应的是( )①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰A.①④ B.②③C.①④⑤ D.②④
2. 已知1 g丙烷完全燃烧生成CO2气体和液态水,放出50.405 kJ热量,下列热化学方程式正确的是( )A.C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-50.405 kJ·ml-1B.C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=+2 217.82 kJ·ml-1C.C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=+50.405 kJ·ml-1D.C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2 217.82 kJ·ml-1
3.已知反应X+Y====M+N为吸热反应,对于这个反应下列说法中正确的是( )A.X的能量一定低于M的,Y的能量一定低于N的B.因为该反应为吸热反应,故一定要加热,反应才能进行C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量D.X和Y的总能量一定低于M和N的总能量
苏教版 (2019)必修 第二册第二单元 化学反应中的热获奖ppt课件: 这是一份苏教版 (2019)必修 第二册第二单元 化学反应中的热获奖ppt课件,共26页。PPT课件主要包含了学习目标,知识梳理,刺激性气味,能力提升,当堂检测等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第二册专题6 化学反应与能量变化第二单元 化学反应中的热课文内容ppt课件: 这是一份高中化学苏教版 (2019)必修 第二册专题6 化学反应与能量变化第二单元 化学反应中的热课文内容ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第二册第二单元 化学反应中的热图文课件ppt: 这是一份高中化学苏教版 (2019)必修 第二册第二单元 化学反应中的热图文课件ppt,共24页。PPT课件主要包含了问题解决,热化学方程式,课堂练习,从宏观角度分析,放热反应,吸热反应,从微观角度分析,H-O-H,课堂总结,随堂演练等内容,欢迎下载使用。













