

所属成套资源:届江西省南昌市新建区第一中学高三高考押题卷及答案
江西省南昌市新建区第一中学2021届高三高考押题卷(四)化学试卷+答案【Word版】
展开
这是一份江西省南昌市新建区第一中学2021届高三高考押题卷(四)化学试卷+答案【Word版】,共14页。
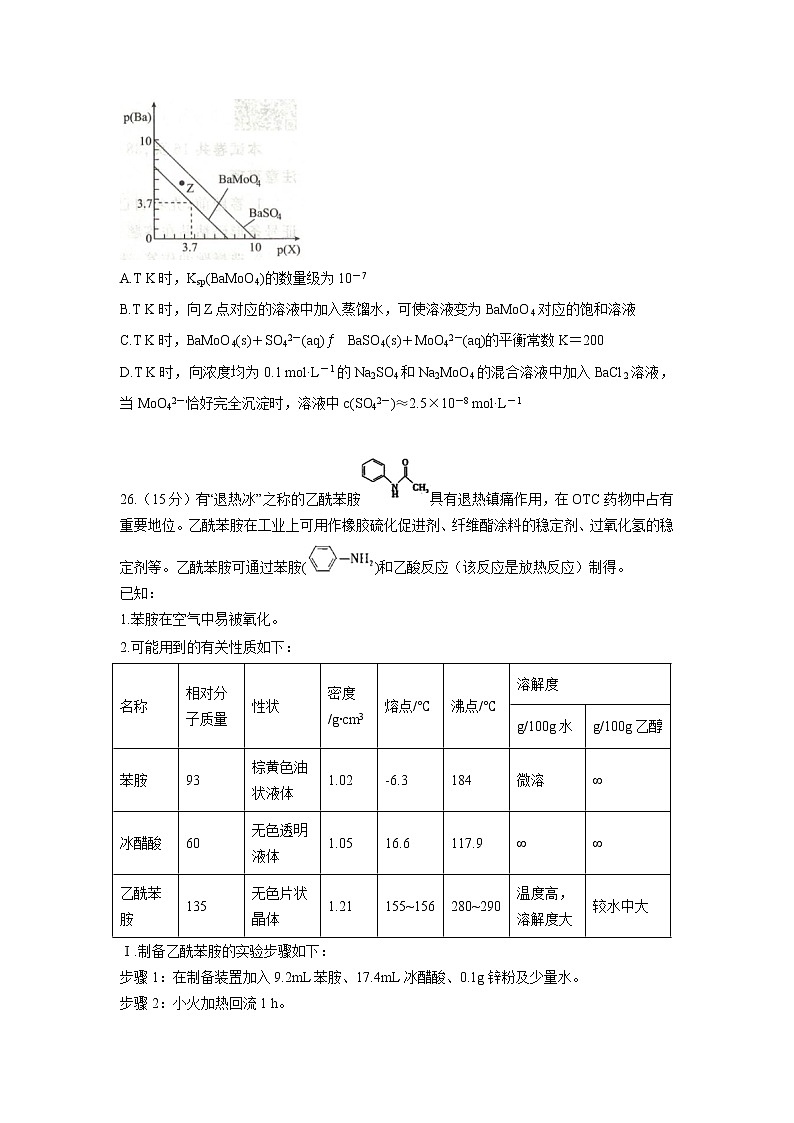
新建一中2021年高考押题卷(四) 可能用到的相对原子质量:H-1 Li-7 C-12 O-16 S-32 Ca-40 Ni-597.纵观古今,化学与生活皆有着密切联系.下列说法错误的是( )A.大气中PM2.5比表面积大,吸附力强,能吸附许多有毒有害物质B.“华为麒麟980”手机中芯片的主要成分是单质硅C.喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性D.有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素,属于天然高分子化合物8.Park等提出的Pd-MgO/SiO2催化剂具有非常广阔的发展与应用前景,从环境保护和能源角度实现了CO2到甲烷的转变,其催化机理如图所示。下列叙述错误的是A.该催化剂中Pd的主要作用是将H2转化成HB.该催化剂可改变原有的反应历程,降低反应的活化能C.该催化过程中MgO未发生变化,不起作用D.该催化过程总反应的化学方程式为CO2+4H2CH4+2H2O9.聚乙酸乙烯酯可由如图所示反应制备。下列说法错误的是A.该反应为酯化反应或缩聚反应 B.X中最多有6个原子在同一平面上C.聚乙酸乙烯酯不能被酸性高锰酸钾溶液氧化 D.X与HCOOCH3互为同分异构体10.X、Y、Z、W为原子序数依次增大的短周期主族元素,X的原子序数等于Y的族序数,W的简单离子半径在同周期元素中最小,由X、Y、Z三种元素形成的化合物的结构式如图所示。下列说法正确的是A.氢化物的稳定性:Y>XB.该化合物中,所有原子最外层均满足8e-稳定结构C.H元素与X、Y组成的三元化合物一定是电解质D.Z、W的简单离子对水的电离均无影响11.利用下表提供的主要玻璃仪器(非玻璃仪器任选)和试剂能实现下列实验目的的是12.羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。一种能将苯酚(C6H5OH)氧化为CO2、H2O的原电池-电解池组合装置如图。该装置能实现发电、环保二位一体。下列说法错误的是A.c极为阴极,M为阳离子交换膜B.b极的电极反应式为C6H5OH-28e-+28OH-=6CO2↑+17H2OC.d极区苯酚被氧化的反应为C6H5OH+28·OH=6CO2↑+17H2OD.右侧装置中,每转移0.7 mol e-,c、d两极共产生气体11.2L(标准状况)13.已知:BaMoO4、BaSO4均难溶于水,lg2≈0.3,离子浓度≦10-5 mol·L-1时认为其沉淀完全。T K时,BaMoO4、BaSO4的沉淀溶解平衡曲线如图所示,其中p(Ba)=-lgc(Ba2+),p(X)=-lgc(MoO42-)或-lgc(SO42-)。下列叙述正确的是A.T K时,Ksp(BaMoO4)的数量级为10-7B.T K时,向Z点对应的溶液中加入蒸馏水,可使溶液变为BaMoO4对应的饱和溶液C.T K时,BaMoO4(s)+SO42-(aq)BaSO4(s)+MoO42-(aq)的平衡常数K=200D.T K时,向浓度均为0.1 mol·L-1的Na2SO4和Na2MoO4的混合溶液中加入BaCl2溶液,当MoO42-恰好完全沉淀时,溶液中c(SO42-)≈2.5×10-8 mol·L-1 26.(15分)有“退热冰”之称的乙酰苯胺具有退热镇痛作用,在OTC药物中占有重要地位。乙酰苯胺在工业上可用作橡胶硫化促进剂、纤维酯涂料的稳定剂、过氧化氢的稳定剂等。乙酰苯胺可通过苯胺()和乙酸反应(该反应是放热反应)制得。已知:1.苯胺在空气中易被氧化。2.可能用到的有关性质如下:名称相对分子质量性状密度/g∙cm3熔点/℃沸点/℃溶解度g/100g水g/100g乙醇苯胺93棕黄色油状液体1.02-6.3184微溶∞冰醋酸60无色透明液体1.0516.6117.9∞∞乙酰苯胺135无色片状晶体1.21155~156280~290温度高,溶解度大较水中大Ⅰ.制备乙酰苯胺的实验步骤如下:步骤1:在制备装置加入9.2mL苯胺、17.4mL冰醋酸、0.1g锌粉及少量水。步骤2:小火加热回流1 h。步骤3:待反应完成,在不断搅拌下,趁热把反应混合物缓慢地倒入盛有250mL冷水的烧杯中,乙酰苯胺晶体析出。冷却,减压过滤(抽滤),用滤液洗涤晶体2~3次。请回答下列问题:⑴写出制备乙酰苯胺的化学方程式 。⑵将三种试剂混合时,最后加入的试剂是 ,这样做的原因是: 。⑶步骤2:小火加热回流1 h,装置如下图所示。请回答下列问题: ①b处使用的仪器为 (填“A”或“B”),该仪器的名称是 。②得到的粗乙酰苯胺固体,为使其更加纯净,还需要进行的分离方法是 。Ⅱ.实验小组通过控制反应温度,测得不同温度下产品的平衡产率如图所示:⑷从图中可知,反应体系温度在100℃-105℃时,乙酰苯胺的产率上升的原因可能是: 。⑸①该实验最终得纯品 10.8g,则乙酰苯胺的产率是 。(精确到小数点后1位)②导致实际值低于理论值的原因可能是 (填字母标号)。A.没有等充分冷却就开始过滤B.抽滤后没有把滤液合并在一起C.乙酰苯胺中的乙酸未除干净 27.(14分)仲钼酸铵[(NH4)6Mo7O24]可用来检测磷的存在,用于地质勘探寻找磷矿。从含有CoS、Al2O3、MoS2、少量碳及有机物的废料中回收制备仲钼酸铵和CoC2O4·2H2O的工艺流程如图所示。已知:①浸取液中的金属离子主要为MoO22+、Co2+、Al3+;②25℃时,CoC2O4的Ksp=4.0×10-6。⑴仲钼酸铵中钼的化合价为_____,焙烧时除了将废料中的含硫化合物转化成SO2和金属阳离子外,还具备的作用是 。⑵焙烧时MoS2转化成MoO3和SO2,则酸浸时MoO3发生反应的离子方程式为 。⑶“操作I”的名称为_____,若选择两种不同萃取剂按一定比例(协萃比)协同萃取MoO22+和Co2+,萃取情况如图所示,当协萃比=____时,更有利于的MoO22+萃取。⑷加硫酸“调pH为5.5”时生成仲钼酸铵的化学反应方程式为______________________。⑸水相2中的离子主要有H+、SO42-和________。Co2+萃取的反应原理为Co2++2HRCoR2+2H+,向有机相2中加入“X”反萃取,则X的化学式是 。⑹一般认为离子浓度达到10-5mol/L时即完全除尽,沉钴过程中,当Co2+完全沉淀时,溶液中C2O42-的浓度至少为_________mol/L。⑺CoC2O4·2H2O在氩气氛围下加热失重如图所示,曲线中300 ℃及以上所得固体均为钴氧化物。通过计算确定C点剩余固体的化学成分为________________(填化学式)。28.(14分)氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。请回答下列问题:(1)煤燃烧产生的烟气中含有氮的氧化物NOx,用CH4催化还原NOx可消除氮氧化物的污染。已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-865.0 kJ·mol-1②2NO(g)+O2(g)=2NO2(g) △H=-112.5 kJ·mol-1③适量的N2和O2完全反应,每生成2.24 L(标准状况下)NO时,吸收8.9 kJ的热量。则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= kJ·mol-1。(2)已知合成氨反应N2(g)+3H2(g)2NH3(g) △H=-92 kJ·mol-1①合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图1所示(其他条件相同),则实际生产中适宜选择的催化剂是v(填“A”、“B”或“C”),理由是 。②科研小组模拟不同条件下的合成氨反应,向刚性容器中充人10.0 mol N2和20.0 mol H2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图2。T1、T2、T3由小到大的排序为 ;在T2、50MPa条件下,A点v正 v逆(填“>”、“<”或“=”);在温度T2压强50 MPa时,平衡常数Kp= MPa-2(列出表达式,分压=总压×物质的量分数)。③合成氨反应在催化剂作用下的反应历程为(*表示吸附态):第一步N2(g)→2N*;H2(g)→2H*(慢反应)第二步N*+H*NH*;NH*+H*NH2*;NH2*+H*NH3*;(快反应)第三步NH3*NH3(g)(快反应)i.第一步反应的活化能E1与第二步反应的活化能E2相比:E1>E2,请写出判断理由 。ii.关于合成氨工艺的下列理解,正确的有 (填写字母编号)。A.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率B.合成氨反应在不同温度下的△H和△S都小于零C.NH3易液化,不断将液氨移去,利于反应正向进行D.原料气中N2由分离空气得到,H2由天然气、水蒸气通过一定反应生成,原料气需要经过净化处理,以防催化剂中毒和安全事故发生35.[化学——选修3:物质结构与性质](15分)元素周期表中第四周期某些过渡元素(如Ti、Mn、Zn等)在生产生活中有着广泛的应用。回答下列问题:(1)钛的应用越来越受到人们的关注。①第四周期元素中,基态原子的未成对电子数与钛相同的有 (填元素符号)。②钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是 。(2)锰及其化合物的应用研究是前沿科学之一。①已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列 (选填字母编号)。②三醋酸锰[(CH3COO)3Mn]是一种很好的有机反应氧化剂。三醋酸锰[(CH3COO)3Mn]中阳离子的价层电子排布式中电子的自旋状态 (填“相同”或“相反”)。③Mn2+能形成配离子为八面体的配合物MnClm·nNH3,在该配合物的配离子中,Mn2+位于八面体的中心。若含1 mol该配合物的溶液与足量AgNO3溶液作用可生成l mol AgCl沉淀,则该配离子化学式为 。(3)比较Fe和Mn的第三电离能,I3(Fe) I3(Mn)(填“大于”或“小于”),原因是 。(4)某钙钛型复合氧化物如图,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有巨磁电阻效应。已知La为+3价,当被钙等+2价元素A替代时,可形成复合钙钛矿化合物LaxA1-xMnO3,(x>0.9),此时一部分+3价锰转变为+4价,导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则复合钙钛矿化合物中+3价锰与+4价锰的物质的量之比为 (用含x的代数式表示)。(5)具有较高催化活性的材料金红石的晶胞结构如图所示。已知该晶体的密度为d g·cm-3,Ti、O原子半径分别为a pm和b pm,阿伏加德罗常数的值为NA,则金红石晶体的空间利用率为 (列出计算式)。 36.[化学——选修5:有机化学基础](15分)化合物M是一种中枢神经兴奋剂,由芳香化合物A制备M的一种合成路线如图所示:③B生成C的反应中只有C一种有机产物。回答下列问题:(1)A的化学名称为 ;B的结构简式为 ;C中所含官能团的名称为 。(2)由D生成E的化学方程式为 。(3)由E生成F所需的试剂和条件分别为 。(4)由G生成M的反应类型为 。(5)F的同分异构体中,能与NaHCO3溶液反应产生气体的芳香化合物有 种(不考虑立体异构),其中核磁共振氢谱中吸收峰最少的有 组吸收峰。(6)参照上述合成路线和信息,以乙烯和CH3CH2NH2为原料(无机试剂任选),设计制备CH3CH2N=CHCH3的合成路线: 。 参考答案:7、答案:D8、答案:C解析:9、答案:A解析:10、答案:B解析::11、答案:C12、答案:13、答案:D26、(15分)答案:(1)+CH3COOH+H2O 2分(2)苯胺 1分 锌粉与醋酸反应生成氢气,可以排出装置中的空气,保护苯胺不被氧化 2分 (3)①B 1分 球形冷凝管 1分 ②重结晶 2分(4)温度高于100℃后,不断分离出反应过程中的水,促进反应正向进行,提高生成物的产率 2分(5)① 79.3% 2分 ②AB 2分27、(14分)(1) +6(1分) 除掉废料中的碳和有机物(1分) (2) MoO3+2H+=MoO22++H2O(2分) (3) 分液(1分) 4:1(1分) (4) 7(NH4)2MoO4+4H2SO4=(NH4)6Mo7O24+4(NH4)2SO4+4H2O(2分) (5) Al3+ (1分) H2SO4(或HCl)(1分)(6) 0.4(2分)(7) Co3O4(2分)28、(14分) 36、
相关试卷
这是一份2021南昌新建区一中高三高考押题卷(一)化学试卷含答案,共15页。试卷主要包含了中国诗词,连花清瘟胶囊在治疗轻型等内容,欢迎下载使用。
这是一份2021南昌新建区一中高三高考押题卷(二)化学试卷含答案,共8页。试卷主要包含了我国工业布局的变化趋势,反映了,阅读图文材料,完成下列要求等内容,欢迎下载使用。
这是一份2021南昌新建区一中高三高考押题卷(三)化学试卷含答案,共12页。试卷主要包含了化合物M都是重要的有机物等内容,欢迎下载使用。









