






新教材2022届新高考化学人教版一轮课件:微专题·大素养 5 拓展性氧化还原反应在高考中的创新应用
展开
这是一份新教材2022届新高考化学人教版一轮课件:微专题·大素养 5 拓展性氧化还原反应在高考中的创新应用,共24页。PPT课件主要包含了Co3O4,Br2,H3PO4,NaOCN,NaCN等内容,欢迎下载使用。
拓展性氧化还原反应在高考中的创新应用近几年高考中,离子型氧化还原反应的应用是常考热点。单独命题不多,但与元素化合物,化学反应原理,化工流程分析和实验创新探究结合紧密。对于考查学生的“辨识探析”能力、“推理认知”能力、“科学创新”能力是一重要的命题点,也是学生必备的化学科学素养。
【真题示例】1.(1)[2019·全国卷Ⅱ,26(2)①]重晶石在回转炉中900~1 200 ℃条件下,被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为 。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为 。(2)[2019·全国卷Ⅲ,26(1)]工业上可由天然二氧化锰粉和硫化锰矿用硫酸溶浸得硫单质和硫酸锰,写出该反应的化学方程式 。
BaSO4+4C===BaS+4CO↑
CO+H2O===CO2+H2
MnO2+MnS+2H2SO4===2MnSO4+S+2H2O
2.(1)[2017·全国卷Ⅲ,27(1)]FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeO·Cr2O3与NaNO3的系数比为 。该步骤不能使用陶瓷容器,原因是_____________________________________________。(2)[2017·全国卷Ⅰ,27(6)]已知FePO4沉淀 LiFePO4,写出该反应的化学方程式___________________________________。
陶瓷中含有SiO2,在高温下会与Na2CO3反应
解析:(1)首先标出变价元素的化合价,分析价态变化可知:1 ml FeO·Cr2O3失去7 ml电子,1 ml NaNO3得到2 ml电子,则由得失电子守恒可知二者系数比应为2∶7;该步骤中主要反应的反应物中有Na2CO3,而陶瓷中含有二氧化硅,二者在熔融时反应,故不能使用陶瓷容器。(2)反应物为FePO4、Li2CO3、H2C2O4,生成物有LiFePO4,铁元素的化合价降低,则H2C2O4中碳元素的化合价升高,产物为CO2,配平。
3.[2016·全国卷Ⅱ,26(2)]实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为__________________________________。
解析:次氯酸钠溶液与氨反应制备联氨的反应中,氮元素的化合价由氨分子中的-3价升高到联氨分子中-2价,氯元素的化合价由次氯酸钠中的+1价降低到-1价,根据化合价升高与降低总数相等和原子守恒配平化学方程式为NaClO+2NH3===N2H4+NaCl+H2O。
NaClO+2NH3===N2H4+NaCl+H2O
4.[2016·天津卷,9(4)]MnO(OH)2+I-+H+―→Mn2++I2+H2O(未配平)其化学计量数依次为 。
解析:Mn元素的化合价由+4价降低到+2价,碘元素的化合价由-1价升高到0价,根据化合价升降总数相等,配平后化学方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O,故其化学计量数依次为1,2,4,1,1,3。
1,2,4,1,1,3
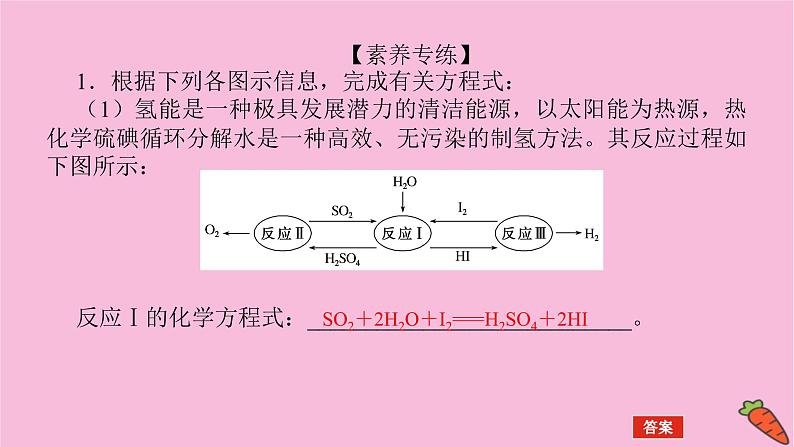
【素养专练】1.根据下列各图示信息,完成有关方程式:(1)氢能是一种极具发展潜力的清洁能源,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:反应Ⅰ的化学方程式:____________________________。
SO2+2H2O+I2===H2SO4+2HI
(2)地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。上图表示足量Fe粉还原上述KNO3溶液过程,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式:________________。
10CuSO4+P4+16H2O===4H3PO4+10Cu+10H2SO4
2KClO3+H2C2O4+2H2SO4===2ClO2↑+2CO2↑+2KHSO4+2H2O
(4)利用钴渣[含C(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:C(OH)3溶解还原反应的离子方程式为 ,铁渣中铁元素的化合价为 ,在空气中煅烧CC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41 g,CO2体积为1.344 L(标准状况),则钴氧化物的化学式为__________。
3.(1)尖晶石型锰酸锂(LiMn2O4)是一种环保绿色能源新型材料。实验室通过下列方法制取:将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5小时,然后升温至600~750 ℃,保温24小时,自然冷却到室温得产品,写出该反应的化学方程式:______________________________________________________。(2)联氨(N2H4)是航天飞船常用的高能燃料,联氨可以用尿素[CO(NH2)2]为原料制取,方法是在KMnO4催化剂存在下,尿素[CO(NH2)2]和次氯酸钠、NaOH溶液反应生成联氨、Na2CO3、另一种钠盐和水,写出其反应的化学方程式:_______________________________________________________。
(3)某反应中反应物与生成物有AsH3、H2SO4、KBrO3、K2SO4、H3AsO4和一种未知物x。已知0.2 ml KBrO3在反应中得到1 ml e-生成x,则x的化学式:________,试写出该反应的化学方程式:______________________________________________________。
4H2SO4+5AsH3+8KBrO3===5H3AsO4+4Br2+4K2SO4+4H2O
4.(1)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。①H3PO2中,P元素的化合价为 。②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为 (填化学式)。(2)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式____________________________________________________。
2P4+3Ba(OH)2+6H2O===3Ba(H2PO2)2+2PH3↑
解析:(1)①H3PO2中P元素化合价为+1价。②根据H3PO2与Ag+反应中两者物质的量之比为1∶4,4 ml Ag+在反应中得到4 ml e-,1 ml H3PO2则失去4 ml e-,所以P元素将显+5价,产物为H3PO4,即氧化产物为H3PO4。(2)依据氧化还原反应方程式配平原则,得:6H2O+2P4+3Ba(OH)2===2PH3↑+3Ba(H2PO2)2。
5.(1)[2021·山东日照一模]草酸钪[Sc2(C2O4)3]在空气中“灼烧”生成Se2O3的化学方程式为_________________________。(2)[2021·山东潍坊一模]从某废催化剂(含ZnO、CuO、Fe2O3、石墨及MnO2等)中回收金属并制取活性氧化锌的工艺流程如下(已知:Zn及其氧化物、氢氧化物的性质与Al及其相应化合物性质类似):“氧化”时Mn2+被氧化的离子方程式为_________________________________________。“中和、沉淀”时,若pH过高,则碱式碳酸锌的产率偏小。写出其反应的离子方程式(任写一个即可):________________________________________。
6.NaCN超标的电镀废水可用两段氧化法处理:①NaCN与NaClO反应,生成NaOCN和NaCl②NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。完成下列填空:(1)第一次氧化时,溶液的pH应调节为 (选填“酸性”“碱性”或“中性”);原因是___________________________________________。(2)写出第二次氧化时发生反应的离子方程式________________________________________________________。
防止生成HCN,造成人员中毒或污染空气
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO g(实际用量应为理论值的4倍才能使NaCN含量低于0.5 mg/L,达到排放标准)。(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成 、 和H2O。
相关课件
这是一份人教版高考化学一轮复习微专题大素养14滴定原理的拓展应用课件
这是一份人教版高考化学一轮复习微专题大素养12应用广泛的新型化学电源课件
这是一份人教版高考化学一轮复习微专题大素养10关注常考stse创新题课件








