





高考化学一轮复习第一章 核心素养提升(一) 化学计算的常用方法课件PPT
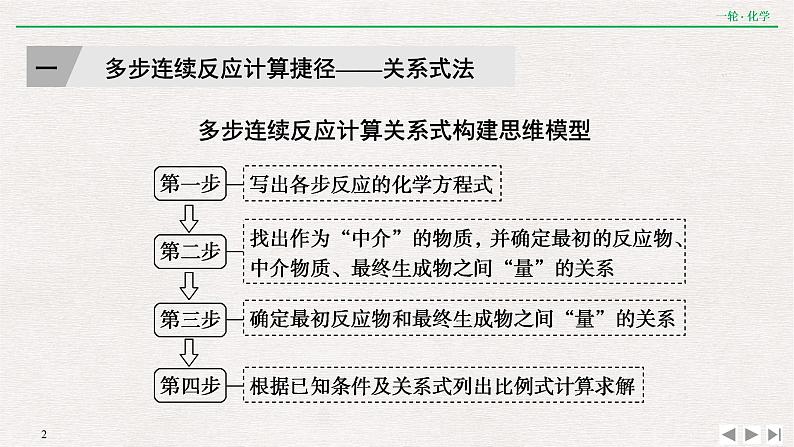
展开多步连续反应计算关系式构建思维模型
一 多步连续反应计算捷径——关系式法
[典例1] 将500 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170 ℃下充分反应,用水乙醇混合液充分溶解产物I2,定容到100 mL。取25.00 mL用0.010 0 ml·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品中CO 的体积分数为________(保留三位有效数字)。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2===2NaI+Na2S4O6)
二 妙用守恒 简化过程
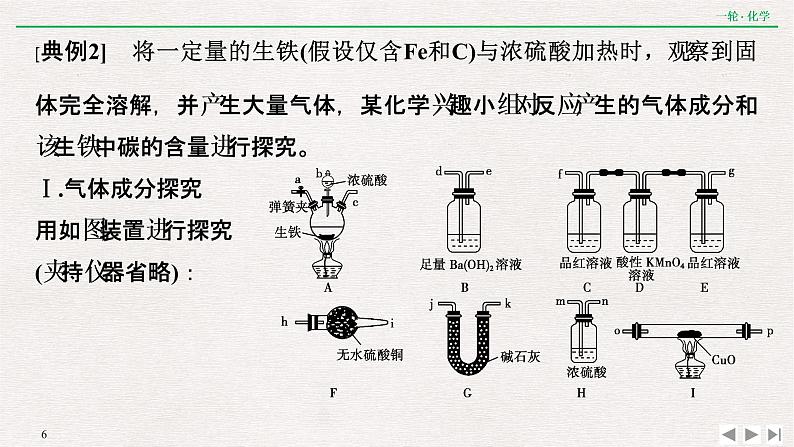
[典例2] 将一定量的生铁(假设仅含Fe和C)与浓硫酸加热时,观察到固体完全溶解,并产生大量气体,某化学兴趣小组对反应产生的气体成分和该生铁中碳的含量进行探究。Ⅰ.气体成分探究用如图装置进行探究(夹持仪器省略):
Ⅱ.生铁中碳的含量探究甲同学在正确连接好实验装置后粗略测定样品中碳的含量。取样品m1 g进行实验,充分反应后,测得B中生成沉淀的质量为m2 g,该样品中碳的质量分数小于______(用含m1、m2的式子表示)。
三 热重分析的方法
[典例4] 0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。 试确定200 ℃时固体物质的化学式(要求写出推断过程)。___________________________________________________________。
[素养专项练]1.碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4 g 上述混合物,消耗1 ml·L-1盐酸500 mL。煅烧等质量的上述混合物,得到氧化铜的质量是( )A.35 g B.30 gC.20 gD.15 g
解析:由题意知,消耗HCl的物质的量为0.5 ml,根据氯元素守恒,则CuCl2的物质的量为0.25 ml。根据Cu元素守恒可知,原混合物中含有Cu元素的物质的量为0.25 ml,煅烧等质量的上述混合物,得到氧化铜的物质的量为0.25 ml,则m(CuO)=0.25 ml×80 g·ml-1=20 g。
2.铜和镁的合金4.6 g完全溶于浓硝酸,若反应后硝酸被还原,只产生4 480 mL的NO2气体和336 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )A.9.02 g B.8.51 gC.8.26 gD.7.04 g
3.有一在空气中暴露过的KOH固体,经分析知其含水7.12%,K2CO3 2.88%,KOH 90%,若将此样品 1 g 加入46.00 mL的1 ml·L-1盐酸中,过量的酸再用1.07 ml·L-1 KOH溶液中和,蒸发中和后的溶液可得固体________g。解析:此题中发生的反应很多,但仔细分析可知蒸发溶液后所得固体为KCl,其Cl-全部来自盐酸中的Cl-,在整个过程中Cl-守恒,即n(KCl)=n(HCl);故m(KCl)=0.046 L×1 ml·L-1×74.5 g·ml-1=3.427 g。答案:3.427
答案:0.100 ml·L-1
5.用如图装置可以测定混合气中ClO2的含量:Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;Ⅲ.将一定量的混合气体通入锥形瓶中吸收;Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
解析:(1)ClO2具有氧化性,I-具有还原性,二者在酸性溶液中发生氧化还原反应,离子方程式为2ClO2+10I-+8H+===5I2+4H2O+2Cl-。答案:(1)2ClO2+10I-+8H+===5I2+4H2O+2Cl-
(2)测得混合气中ClO2的质量为________g。
答案:(2)0.027 00
6.氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺流程如图:
易错题重练与新素材命题(一)01 章末排查练1.化学计量判断正误(正确的打“√”,错误的打“×”)。(1)“物质的量”是国际单位制中的一个基本单位。( )(2)阿伏加德罗常数就是6.02×1023ml-1。( )(3)CO2的摩尔质量是44 g·ml-1,表示1 ml CO2的质量为44 g。( )(4)H2SO4溶液的物质的量浓度为1 ml·L-1,表示1 L溶液中含有1 ml H2SO4。( )
(5)气体摩尔体积Vm≈22.4 L·ml-1,表示1 ml任何气体的体积都约为22.4 L。( )(6)阿伏加德罗常数NA≈6.02×1023 ml-1,表示1 ml任何粒子集合体所含的粒子数约为6.02×1023。( )(7)摩尔是用来衡量微观粒子多少的一种物理量。( )(8)在一定的温度和压强下,各种气态物质体积的大小由构成气体的分子数决定。( )(9)在一定的温度和压强下,各种气体的摩尔体积相等。( )(10)阿伏加德罗常数的数值是0.012 kg碳所含的原子个数。( )
2.“NA”关联类判断正误(正确的打“√”,错误的打“×”)。(1)含NA个阴离子的Na2O2溶于水形成1 L溶液,所得溶液的浓度为1 ml/L。( )(2)20 g氖气中所含的原子数为NA。( )(3)7.8 g苯中含有的碳碳双键数为0.3NA。( )(4)常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA。( )(5)1 L 0.1 ml/L CuSO4溶液中含有Cu2+的数目为0.1NA。( )
(6)2.24 L N2和NH3的混合气体,含有的共用电子对数目为0.3NA。( )(7)2 ml SO2和1 ml O2在一定条件下充分反应后,所得混合气体的分子数大于2NA。( )(8)1.0 L 1.0 ml·L-1的NaAlO2水溶液中含有的氧原子数为2NA。( )(9)25 ℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA。( )(10)1 ml Na被完全氧化生成Na2O2,失去2NA个电子。( )(11)在过氧化钠与水的反应中,每生成0.1 ml氧气,转移电子的数目为0.4NA。( )
(12)1 L 1 ml·L-1CH3COOH溶液中,所含CH3COO-、CH3COOH的总数为NA。( )(13)1 L 1 ml·L-1饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶体粒子数为NA。( )(14)10 g 46%的乙醇水溶液中所含H原子数为0.6NA。( )
02 答题语言再规范1.实验室需要0.5 ml·L-1的NaOH溶液470 mL,配制时应称量________ g NaOH,称量时需要________、________、________(填仪器名称)。答案:10.0 托盘天平 小烧杯 药匙
2.检查容量瓶是否漏水的方法:_________________________________________________________________________________________________________________________________________________________。答案:向容量瓶中加入适量水,盖好瓶塞,右手食指顶住瓶塞,左手托住瓶底,将容量瓶倒转过来看瓶口处是否有水渗出,若没有,将容量瓶正立,将瓶塞旋转180度,重复上述操作,如果瓶口仍无水渗出,则此容量瓶不漏水
3.配制一定物质的量浓度溶液定容时的操作是_______________________________________________________________________________。答案:往容量瓶中缓慢加蒸馏水,等液面离容量瓶瓶颈刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切
4.氯化亚铜在氯的衍生物产品中占有较突出的位置,在有机合成工业中可作催化剂。如图是从含Cu2+、Fe3+的电镀废水中制备氯化亚铜的工艺流程图。结晶后采用无水乙醇洗涤的原因是________________________________________________________________________________________。
解析:CuCl晶体不溶于乙醇,可以用乙醇洗去晶体表面杂质,且乙醇容易挥发,比较容易干燥。答案:降低CuCl在洗涤时的损失,且乙醇容易挥发
5.为测定镁铝合金中铝的含量,设计如图所示的实验:
(1)锥形瓶中发生反应的化学方程式:________________________________________________________________________________________。(2)读数前调平B、C装置液面的方法是______________________,其目的是_______________________________________________________。(3)若拆去实验中导管a,使测得气体体积______________________(填“偏大”“偏小”或“无影响”)。答案:(1)2Al+2NaOH+2H2O===2NaAlO2+3H2↑(2)上下缓慢移动量气管C 使B内的气压等于外界大气压 (3)偏大
03 新素材命题与学科素养[命题新素材] 铅酸蓄电池自1859年由普兰特发明以来,至今已有一百多年的历史,技术十分成熟,是全球上使用最广泛的化学电源,广泛应用于汽车、电动车以及通讯、仪器仪表、雷达系统等领域。随着世界能源经济的发展和人民生活水平的日益提高,在二次电源使用中,铅蓄电池已占有85%以上的市场份额。铅酸蓄电池以技术成熟、成本低、大电流放电性能佳、适用温度范围广、安全性高,可做到完全回收利用等优点在汽车起动电池和电动车领域尚无法被其他电池取代。我国每年产生的废旧铅酸蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。
一种回收铅的工艺流程如图:
[设题新角度]问题1.过程Ⅰ,已知:PbSO4、PbCO3的溶解度(20 ℃)如图1;Na2SO4、Na2CO3的溶解度如图2。
过程Ⅱ的目的是脱硫。滤液Ⅰ经处理后可在过程Ⅱ中重复使用,其目的可能是什么?(素养角度——变化观念与平衡思想)
2024年高考化学一轮复习化学计算的常用方法课件: 这是一份2024年高考化学一轮复习化学计算的常用方法课件,共47页。PPT课件主要包含了复习目标,利用差量法计算,考点一,必备知识,专项突破,利用关系式法计算,考点二,利用守恒法计算,考点三,热点强化等内容,欢迎下载使用。
2023年高考化学一轮复习化学计算的常用方法课件: 这是一份2023年高考化学一轮复习化学计算的常用方法课件,共23页。PPT课件主要包含了考点内容,守恒法,关系式法,差量法,平均值法等内容,欢迎下载使用。
2024年高考化学一轮复习 第4讲 化学计算的常用方法课件PPT: 这是一份2024年高考化学一轮复习 第4讲 化学计算的常用方法课件PPT,共60页。PPT课件主要包含了利用差量法计算,归纳整合,专项突破,利用关系式法计算,利用守恒法计算,真题演练明确考向,课时精练等内容,欢迎下载使用。












