





新教材2022届新高考化学人教版一轮课件:微专题·大素养 8 含硫化合物的转化与应用
展开
这是一份新教材2022届新高考化学人教版一轮课件:微专题·大素养 8 含硫化合物的转化与应用,共52页。PPT课件主要包含了答案B,答案D,Fe2SO43,SO2,ABD,c→d→b→a→e,ZnSO3,H2SO4,0×10-3等内容,欢迎下载使用。
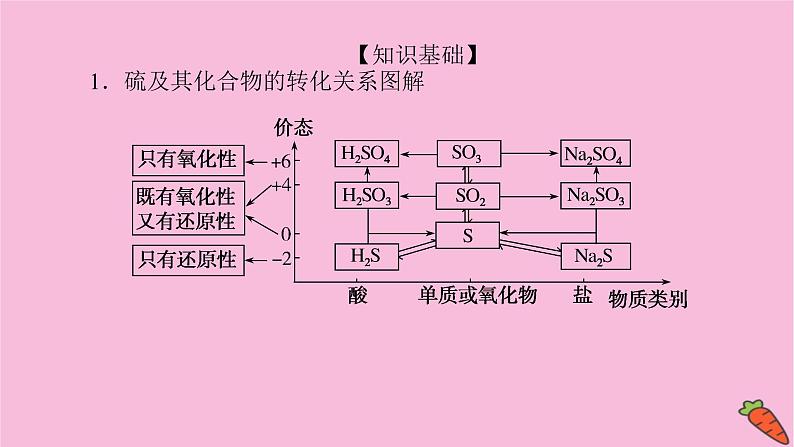
【知识基础】1.硫及其化合物的转化关系图解
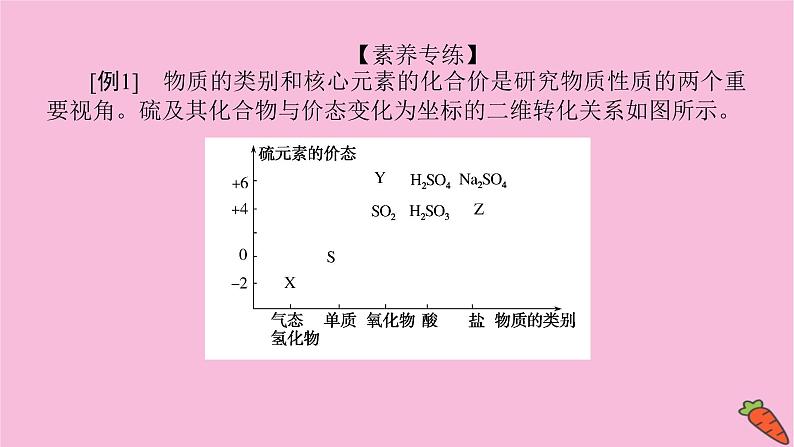
【素养专练】[例1] 物质的类别和核心元素的化合价是研究物质性质的两个重要视角。硫及其化合物与价态变化为坐标的二维转化关系如图所示。
完成下列填空:(1)图中X的电子式为 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式:________________________________;该变化说明S的非金属性比O (填“强”或“弱”)。(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度,理论上有可能的是 (填字母)。a.Na2S+S b.Z+Sc.Na2SO3+Y d.NaHS+NaHSO3
2H2S+O2===2S↓+2H2O
解析:(1)X为H2S,S最外层6个电子,能够与2个H原子形成共价键,其电子式为 ;H2S在空气中变浑浊是因为被氧气氧化为S,反应的化学方程式为2H2S+O2===2S↓+2H2O,所以S非金属性比O弱。(2)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c中S的化合价都大于2,b、d符合题意。
(3)治理含CO、SO2的烟道气,以Fe2O3作催化剂,将CO、SO2在380 ℃时转化为S和一种无毒气体,写出该治理烟道气反应的化学方程式:_________________________________________。
[练1] 某硫酸厂废气中SO2的回收利用方案如图所示。下列说法不正确的是( )A.X中可能含有两种盐B.a是SO3C.Y主要含有(NH4)2SO4D.(NH4)2S2O8中S元素的化合价不可能为+7
解析:SO2与氨水作用可生成(NH4)2SO3和NH4HSO3,A正确;a是SO2,B错误;(NH4)2SO3、NH4HSO3与足量硫酸反应生成(NH4)2SO4,C正确;S元素的最高化合价为+6,(NH4)2S2O8中有两个O显-1价,存在过氧键,D正确。
[练2] CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是( )A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2B.与途径①③相比,途径②更好地体现了绿色化学思想C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②<③D.利用途径②制备16 g硫酸铜,被还原的硫酸的物质的量为0.1 ml
解析:葡萄酒酿造时通入SO2起到了杀菌和增酸的作用,A项正确;反应①中通入N2的目的是将产生的SO2气体完全吹出后用吸收液吸收,从而提高实验的准确率,若不通入N2,则测得的SO2含量偏低,B项正确;反应①中煮沸的目的是加快亚硫酸的分解,降低SO2的溶解度,C项正确;若将H2O2溶液替换为溴水,如果溴过量,溴会与氢氧化钠反应,所以无法根据氢氧化钠的物质的量确定生成的硫酸的物质的量,D项错误。
[练4] 几种常见物质的转化关系如图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。
SO2+H2O2===H2SO4
二、化工生产中含硫化合物的综合分析[例2] 烟气脱硫是控制二氧化硫污染的主要技术手段。(1)利用海水脱硫是一种有效的方法,其工艺流程如图所示:
某研究小组为探究提高含硫烟气中SO2的吸收率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。
①根据图示实验结果,为了提高一定浓度含硫烟气中SO2的吸收率,下列措施正确的是 (填字母编号)。A.降低通入含硫烟气的温度B.减小通入含硫烟气的流速C.减少天然海水的进入量D.在天然海水中加入生石灰②天然海水吸收了含硫烟气后会溶有H2SO3,使用空气中的氧气将其氧化,写出该反应的离子方程式:________________________________________________________
2H2SO3+O2===4H++2SO2-4
③该小组采用如图装置在实验室测定烟气中SO2的体积分数(假设实验在标准状况下进行)。上述装置连接的顺序是原料气→ (填导管接口序号)。下列试剂中(浓度、体积一定),可以用来代替试管中的碘淀粉溶液的是 (填字母编号)。A.酸性KMnO4溶液 B.NaOH溶液C.溴水 D.氨水
解析:(1)③原料气先通过一定浓度和一定体积的碘淀粉溶液,其中SO2与I2反应,当I2恰好反应完时,溶液由蓝色变成无色,此时再通过量气方式读出量筒中水的体积,即为烟气中其他气体的体积,可以进行计算,故装置的连接顺序是原料气→c→d→b→a→e;若用其他试剂代替碘淀粉溶液,则该试剂能与SO2反应,且恰好反应完时有明显的颜色变化,酸性高锰酸钾溶液和溴水都可以。
(2)石灰石石膏湿法烟气脱硫工艺技术的工作原理是烟气中的二氧化硫与浆液中的碳酸钙及鼓入的空气反应生成石膏(CaSO4·2H2O)。写出该反应的化学方程式:_______________________________________________________。某电厂用煤300 t(煤中含硫质量分数为2.5%),若燃烧时煤中的硫全部转化成二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则可生产石膏 t。
2CaCO3+2SO2+O2+4H2O===2(CaSO4·2H2O)+2CO2
[练6] SO2的大量排放是会引发酸雨的重要前提,含有SO2的烟气需处理后才能排放。(1)高温条件下,芒硝(Na2SO4·10H2O)与CO反应生成Na2CO3和SO2的化学方程式为 。
Na2SO4·10H2O+CONa2CO3+SO2+10H2O
解析:(1)反应物有Na2SO4·10H2O与CO,生成物有Na2CO3、SO2及H2O,根据电子守恒及原子守恒配平。
(2)氧化镁(MgO)可用于去除烟气(主要含N2、O2、SO2、CO2等)中的SO2。①MgO加水并加热进行熟化反应生成Mg(OH)2,将制成的Mg(OH)2浆液打入烟气吸收塔。下列措施中,能提高烟气中SO2去除率的有 (填字母)。A.适当减缓通入烟气的速率B.采用气-液逆流的方式吸收烟气C.加水使Mg(OH)2完全溶解
解析:(2)①A项,减缓通入烟气速率,延长吸收时间,提高SO2吸收率,正确;B项,增大吸收面积,提高SO2吸收率,正确;C项,加水,使Mg(OH)2稀释,SO2吸收率降低,错误。
②Mg(OH)2浆液循环吸收烟气中SO2的主要反应为:Mg(OH)2(s)+SO2(g)+5H2O(l)===MgSO3·6H2O(s)MgSO3·6H2O(s)+SO2(g)===Mg(HSO3)2(s)+5H2O(l)除有微溶于水的MgSO3·6H2O(s)和Mg(HSO3)2(s)生成外,还能生成的含镁化合物为 (填化学式);随着循环吸收反应的进行,烟气中SO2去除率降低的主要原因是 。
MgSO4[MgCO3、Mg(HCO3)2]
Mg(OH)2的量不断减少,生成的MgSO3·6H2O(s)、Mg(HSO3)2(s)覆盖在Mg(OH)2表面,阻止反应进一步进行
解析:②亚硫酸盐具有较强的还原性,易被氧化生成MgSO4,烟气中还含有CO2,Mg(OH)2浆液吸收CO2生成MgCO3、Mg(HCO3)2。
②将一定量的烟气匀速通入一定量的软锰矿浆中,反应相同时间,SO2的去除率随温度变化曲线如图2所示,在30~50℃范围内,随着温度升高,SO2的去除率几乎不变,原因是____________________________________________________________________________________________________________。
随着温度升高,化学反应速率加快,SO2去除率升高;同时SO2的溶解度降低,导致SO2去除率降低,两种因素影响相当,导致SO2去除率几乎不变
本讲真题研练1.[2020·浙江1月,24]100%硫酸吸收SO3可生成焦硫酸(分子式为H2S2O7或H2SO4·SO3)。下列说法不正确的是( )A.焦硫酸具有强氧化性B.Na2S2O7水溶液呈中性C.Na2S2O7可与碱性氧化物反应生成新盐D.100%硫酸吸收SO3生成焦硫酸的变化是化学变化
解析:本题考查焦硫酸的化学性质。焦硫酸钠溶于水生成硫酸氢钠,其水溶液呈酸性,B错误;焦硫酸中硫元素为+6价,处于最高价,它与浓硫酸相似,具有强氧化性,A正确;焦硫酸具有酸的通性,能与碱性氧化物反应生成盐,C正确;100%硫酸吸收SO3有焦硫酸生成,发生了化学变化,D正确。
2.[2017·北京卷,10]根据SO2通入不同溶液中的实验现象,所得结论不正确的是( )
3.[2017·江苏卷,4]下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
解析:A项,稀H2SO4与铜片不反应,错误;B项,SO2能使品红溶液褪色,体现其漂白性,正确;C项,SO2密度比空气大,应“长进短出”,错误;D项,SO2不与NaHSO3反应,无法吸收SO2,错误。
(1)氨水吸收SO2。向氨水中通入少量SO2,主要反应的离子方程式为 ;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是 (填化学式)。
(2)ZnO水悬浊液吸收SO2。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40 min内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是 (填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为 。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是 。(2)由图1和图2判断使用硫杆菌的最佳条件为 。若反应温度过高,反应速率下降,其原因是______________________________________。方法2:在一定条件下,用H2O2氧化H2S
降低反应活化能(或作催化剂)
30 ℃、pH=2.0
蛋白质变性(或硫杆菌失去活性)
解析:(1)由硫杆菌存在时的反应速率增大5×105倍可知,硫杆菌为该反应的催化剂,该反应中硫杆菌改变了反应路径,降低了反应的活化能。(2)由图1可知,温度在30 ℃左右时,速率最快;由图2可知,反应混合液的pH=2.0左右时,速率最快。由此可推断使用硫杆菌的最佳条件为温度为30 ℃、混合液的pH=2.0。若反应温度过高,硫杆菌蛋白质受热变性失活,导致反应速率下降。
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为 。
解析:(3)用H2O2氧化H2S时,H2O2被还原为H2O。当n(H2O2)/n(H2S)=4时,n(H2O2)=4 ml,则n(H2S)=1 ml,并设氧化产物中S的化合价为x,由氧化还原反应的电子守恒规律,可得:4×2×[(-1)-(-2)]=1×[x-(-2)],解得x=+6。所以氧化产物的分子式为H2SO4。
Ⅱ.SO2的除去方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生NaOH溶液 Na2SO3溶液(4)写出过程①的离子方程式: ;CaO在水中存在如下转化:CaO(s)+H2O(l)===Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)从平衡移动的角度,简述过程②NaOH再生的原理 。
相关课件
这是一份2024版新教材高考化学全程一轮总复习第四章非金属及其化合物微专题大素养8多硫含氧酸盐课件,共17页。PPT课件主要包含了实验装置如图所示,作安全瓶防倒吸,Na2SO4,NaOH溶液等内容,欢迎下载使用。
这是一份2023高考化学总复习微专题大素养含硫化合物的转化与应用08课件,共44页。PPT课件主要包含了知识基础,素养专练,答案B,答案D,H2S,ABD,c→d→b→a→e,真题演练·素养通关,答案C,ZnSO3等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习微专题大素养12应用广泛的新型化学电源课件








