



化学苏教版 (2019)专题6 化学反应与能量变化本单元综合与测试精品ppt课件
展开1.书写电极反应式的原则电极反应式遵循质量守恒、得失电子守恒及电荷守恒,遵循离子方程式的书写规则,两电极反应式相加得电池总化学(或离子)方程式。2.书写电极反应式的基本类型(1)类型一 题目给定原电池的装置图,未给总反应式①首先找出原电池的正、负极,即分别找出氧化剂和还原剂。②结合电解质判断出还原产物和氧化产物。
④将两电极反应式相加(注意两极得失电子数相等)可得电池总反应式。
(2)类型二 题目给出原电池的总反应式①分析原电池总反应式中各元素的化合价变化情况,找出氧化剂及其对应的还原产物,氧化剂发生的反应即为正极反应;找出还原剂及其对应的氧化产物,还原剂发生的反应即为负极反应。②当氧化剂、还原剂、氧化产物、还原产物由多种元素组成时,还应考虑电解质是否参与了反应。③若有一个电极反应式较难写出,可先写出较易写出的电极反应式,然后再用总反应式减去该电极反应式即得到另一电极反应式。
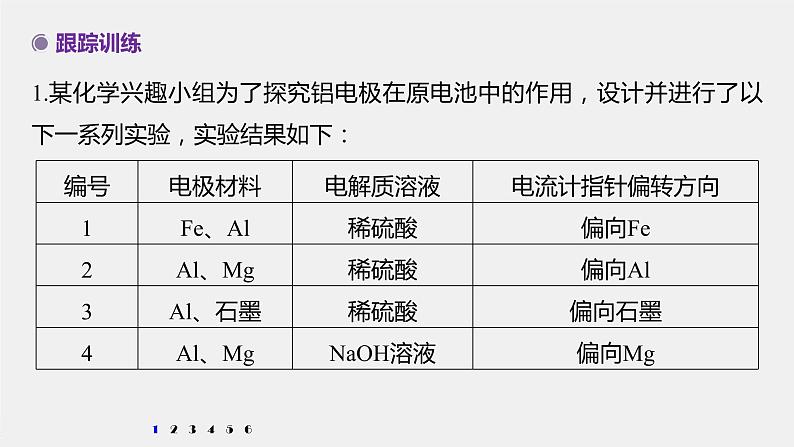
1.某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果如下:
根据上表记录的实验现象,回答下列问题:(1)实验1、2中铝的作用是否相同?__________________________________________________________________________。写出实验1中铝电极上发生的电极反应式:________________。实验2中,镁为____极,电极反应式为_________________。
实验1、2中铝的作用不同,实验1中,
铝作原电池的负极,实验2中铝作原电池的正极
Al-3e-===Al3+
Mg-2e-===Mg2+
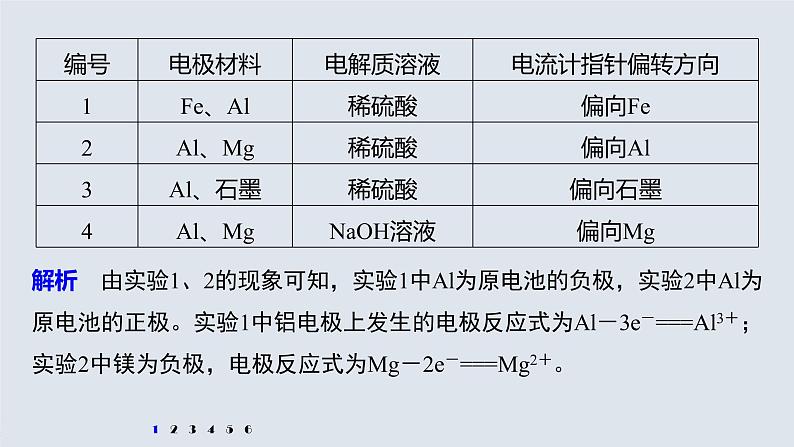
解析 由实验1、2的现象可知,实验1中Al为原电池的负极,实验2中Al为原电池的正极。实验1中铝电极上发生的电极反应式为Al-3e-===Al3+;实验2中镁为负极,电极反应式为Mg-2e-===Mg2+。
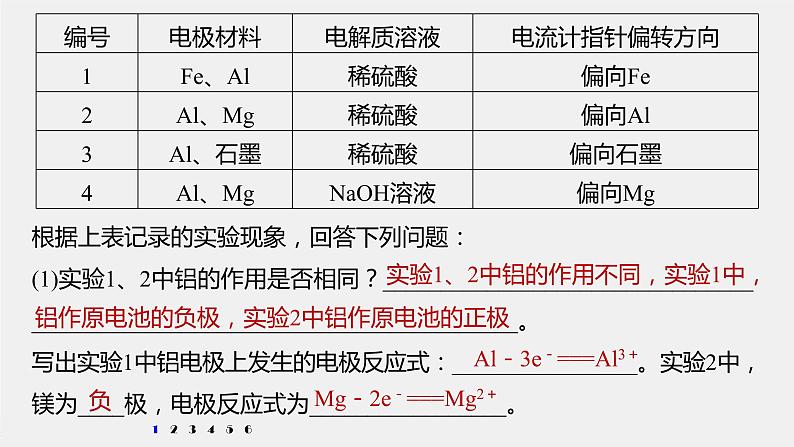
(2)实验3中,铝为____极,石墨为___极,电池总反应式为_________________________________。
===Al2(SO4)3+3H2↑
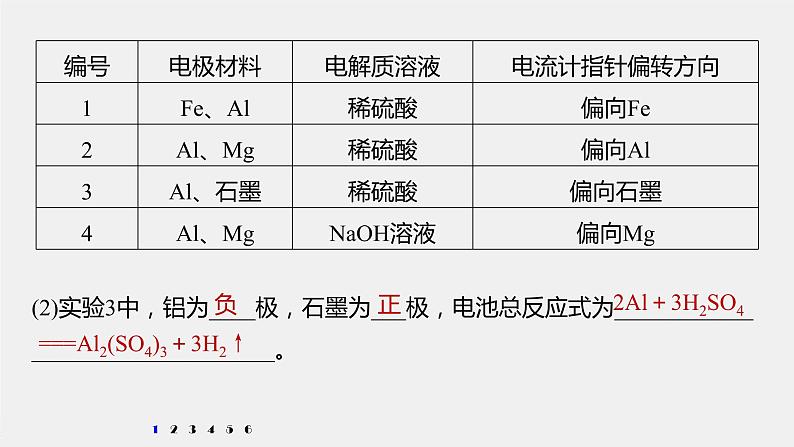
解析 由实验3的现象可知,Al为原电池的负极,石墨为原电池的正极,负极发生氧化反应,电极反应式为2Al-6e-===2Al3+,正极发生还原反应,电极反应式为6H++6e-===3H2↑,电池总反应式为2Al+3H2SO4 ===Al2(SO4)3+3H2↑。
(3)实验4中,铝为___极,原因为______________________________,负极的电极反应式为_______________________________。
铝可以和氢氧化钠溶液发生反应
解析 由实验4的现象可知,Mg作正极,Al作负极,因为Al可以和NaOH溶液发生自发的氧化还原反应,2Al+2NaOH+2H2O===2NaAlO2+3H2↑,负极电极反应式为Al-3e-+4OH-=== +2H2O。
2.如图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
(1)酸式电池的电极反应:负极:_________________,正极:________________________;电池总反应:________________。
2H2-4e-===4H+
+4H+===2H2O
2H2+O2===2H2O
解析 正极上,O2得电子变为O2-,溶液中O2-不能单独存在,酸性条件下与H+结合成H2O。负极上,H2失电子变为H+,H+进入电解质溶液。
(2)碱式电池的电极反应:负极:__________________________,正极:__________________________;电池总反应:___________________。
2H2-4e-+4OH-===4H2O
O2+4e-+2H2O===4OH-
解析 正极上,O2得电子变为O2-,溶液中O2-不能单独存在,碱性条件下与H2O结合成OH-。负极上,H2失电子变为H+,碱性条件下H+不能大量存在,与OH-结合成H2O。
3.铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。根据上述情况判断:(1)工作时,电解质溶液的pH______(填“增大”“减小”或“不变”)。(2)工作时,电解质溶液中的阴离子移向___极(填“正”或“负”,下同)。(3)电流方向从____极流向____极。(4)写出负极的电极反应式:________________________。(5)当铅蓄电池向外电路提供1 ml电子时,理论上负极板的质量增加____ g。
4.(1)由Fe、Cu与稀硫酸组成的原电池中,负极反应式为________________,正极反应式为________________,电池总反应为_____________________。
解析 Fe作负极,电极反应式为Fe-2e-===Fe2+;Cu作正极,电极反应式为2H++2e-===H2↑。
Fe-2e-===Fe2+
2H++2e-===H2↑
Fe+2H+===Fe2++H2↑
(2)由Pb、Cu与稀盐酸组成的原电池,其正极反应式为________________,负极反应式为_______________。
解析 由Pb、Cu与稀盐酸组成的原电池,正极为Cu,电极反应式为2H++2e-===H2↑;负极为Pb,电极反应式为Pb-2e-===Pb2+。
Pb-2e-===Pb2+
(3)由Al、Cu与浓硫酸组成的原电池,其负极反应式为________________。
解析 由Al、Cu与浓硫酸组成的原电池,Al遇浓硫酸钝化,Cu作负极,电极反应式为Cu-2e-===Cu2+。
Cu-2e-===Cu2+
5.ZPwer电池使用锌聚合物作为负极和银纳米颗粒作为正极,其安全性类似于传统的碱性电池,并且其材料95%可回收,该电池的容量比同体积的锂电池高30%。银锌电池广泛用作各种电子仪器的电源,它的充、放电过程可表示为2Ag+Zn(OH)2 Ag2O+Zn+H2O。根据上述信息回答下列问题:(1)电池在放电时,作为负极的是_____,正极反应式为_______________________________。
Ag2O+H2O+2e-
===2Ag+2OH-
解析 根据总反应式可知,逆过程为放电过程,故被氧化的Zn为负极,Ag2O为正极。
(2)该电池属于_____(填“酸”“碱”或“中”)性电池。(3)充电时的能量转化形式:由_____能转化为______能。
解析 从产物分别为金属氧化物和氢氧化物来看,该电池的电解质溶液应为碱性。
6.科学家预言,燃料电池是21世纪获得电子的重要途径。一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在硫酸电解液中直接加入净化后的甲醇,同时向一个电极通入空气。已知电池放电时发生的化学反应方程式:2CH3OH+3O2===2CO2+4H2O。请回答下列问题:(1)在硫酸电解液中,CH3OH失去电子,该电池的正极发生的反应是______________________;负极发生的反应是__________________________________。
O2+4H++4e-===2H2O
CH3OH+H2O-6e-===
解析 书写电极反应方程式注意电解质溶液,本题是酸性溶液。
(2)电解液中的H+向_____极移动;向外电路释放电子的电极是____极。
解析 由电极反应可知,H+在正极消耗,在负极生成,所以向正极移动。
(3)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先燃料电池的能量转化效率高,其次_____________。
解析 燃料电池除能量转化率高外,还减少了大气污染。
燃料电池电极反应式的书写(1)写出电池总反应式燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质反应,则总反应为加合后的反应。甲烷燃料电池(电解质溶液为NaOH溶液)的总反应为CH4+2O2+2NaOH===Na2CO3+3H2O。
(2)写出电池的正极反应式无论负极燃料是H2还是含碳燃料(CO、CH4、CH3OH、C4H10、C2H5OH……),正极一般都是O2发生还原反应,若在碱性条件下,正极反应式为O2+2H2O+4e-===4OH-,若在酸性条件下,正极反应式为O2+4H++4e-===2H2O。(3)写出电池的负极反应式负极反应式=总反应式-正极反应式。
专题四 主观题突破 电极反应式书写及电化学计算 2024年高考化学二轮复习课件+讲义: 这是一份专题四 主观题突破 电极反应式书写及电化学计算 2024年高考化学二轮复习课件+讲义,文件包含专题四主观题突破电极反应式书写及电化学计算pptx、专题四主观题突破电极反应式书写及电化学计算教师版docx、专题四主观题突破电极反应式书写及电化学计算docx等3份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
专题四 电化学 主观题突破 电极反应式书写及电化学计算课件-2024年高考化学二轮复习: 这是一份专题四 电化学 主观题突破 电极反应式书写及电化学计算课件-2024年高考化学二轮复习,共29页。PPT课件主要包含了真题演练,HCOO-+,H2SO4,从右往左,N2+6H2O,Na+,考向预测,×104mol,提高了电流效,O2和较浓的硫酸等内容,欢迎下载使用。
选择性必修1第二单元 化学能与电能的转化获奖ppt课件: 这是一份选择性必修1第二单元 化学能与电能的转化获奖ppt课件,共43页。PPT课件主要包含了Cu或C,Al2SO43,K2SO4等内容,欢迎下载使用。













