



初中化学人教版九年级上册课题2 原子的结构集体备课课件ppt
展开
这是一份初中化学人教版九年级上册课题2 原子的结构集体备课课件ppt,共29页。PPT课件主要包含了原子的构成,你知道吗,原子核,电荷种类,质子数,电子层,第二层,第一层,第三层,最外层等内容,欢迎下载使用。
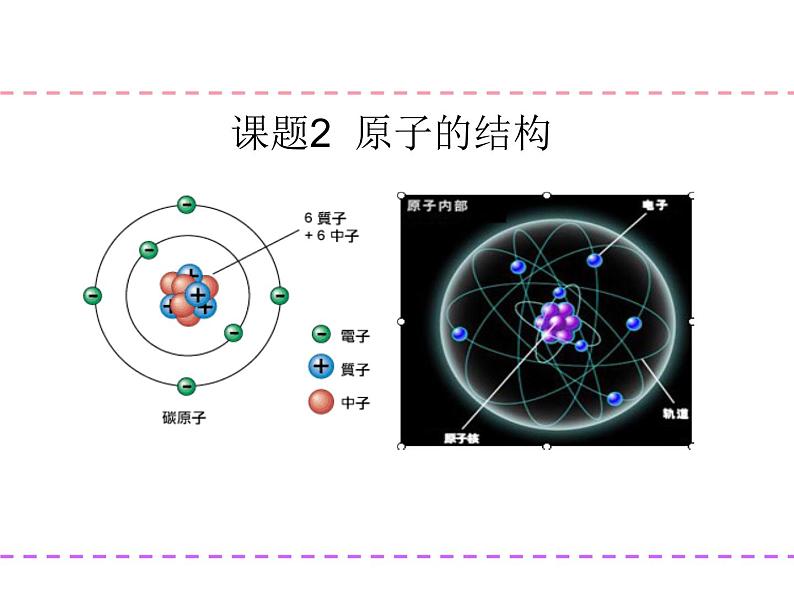
第三单元 物质构成的奥秘
(1)了解原子是由质子、中子和电子构成的,以及构 成粒子之间的关系。 (2)初步了解原子核外电子是分层排布的。(3)初步学会分析原子结构示意图。
重点:原子的构成;核外电子排布。难点:核电荷数、核内质子数和核外电子数的关系。 核外电子运动的特点。
你想象中的原子是什么样的?
大多数带正电的α粒子能够穿透金箔而不改变方向,说明原子是否为实心球体?
少数带正电的α粒子发生方向上的偏转,极少数带正电的α粒子被反弹,说明原子的构成是否像乒乓球一样,内部完全是空的?
根据实验现象,你认为相对来说,原子核外的空间是否很大?
假如“你”是卢瑟福,该怎样解释这些现象?
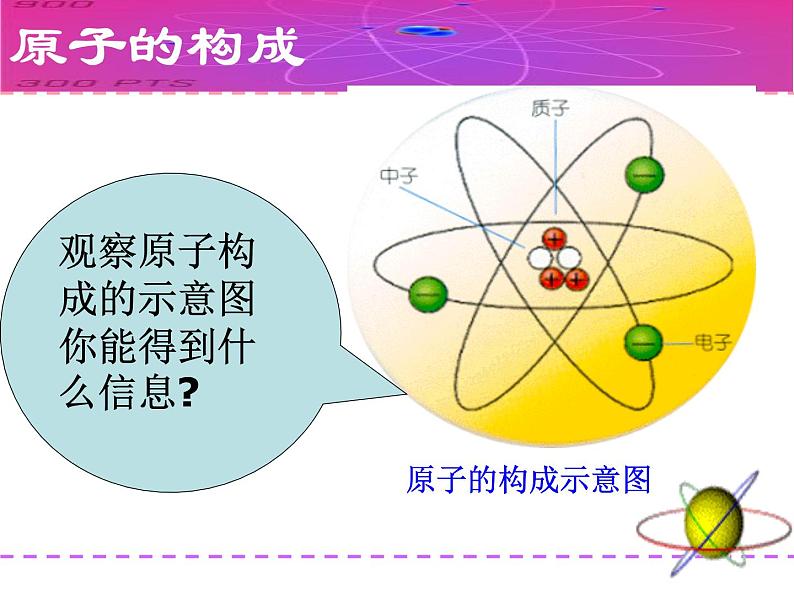
观察原子构成的示意图你能得到什么信息?
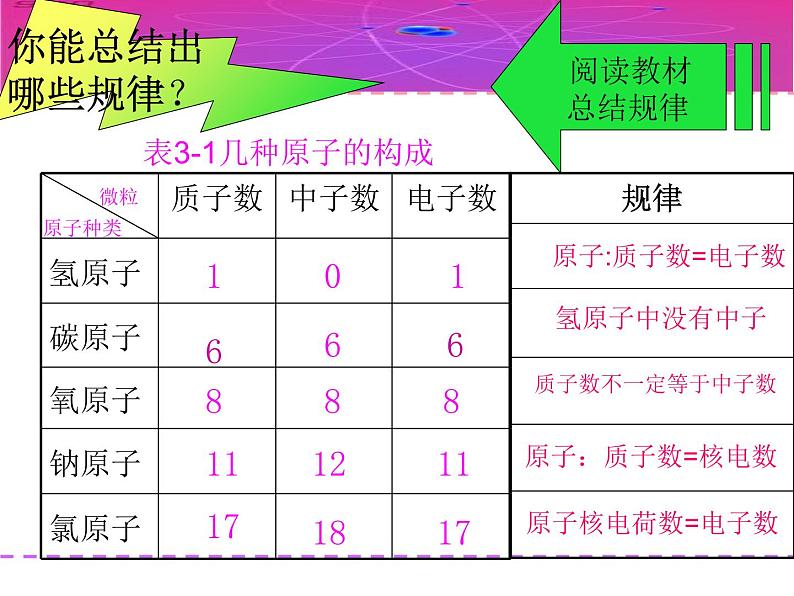
表3-1几种原子的构成
质子数不一定等于中子数
观察表格(表3-1),思考讨论下列问题
1.不同种类原子之间有哪些区别?
2.所有原子都是由质子、中子、电子构成的吗?
原子种类不同,质子数不同,电子数也不同。
不是所有的原子都有中子。如氢原子
观察表格(表3-1),思考下列问题
3.同种原子核内质子数、中子数在数量上有什么系?
4.质子数、电子数、核电荷数有什么联系?
质子数=核外电子数=核电荷数
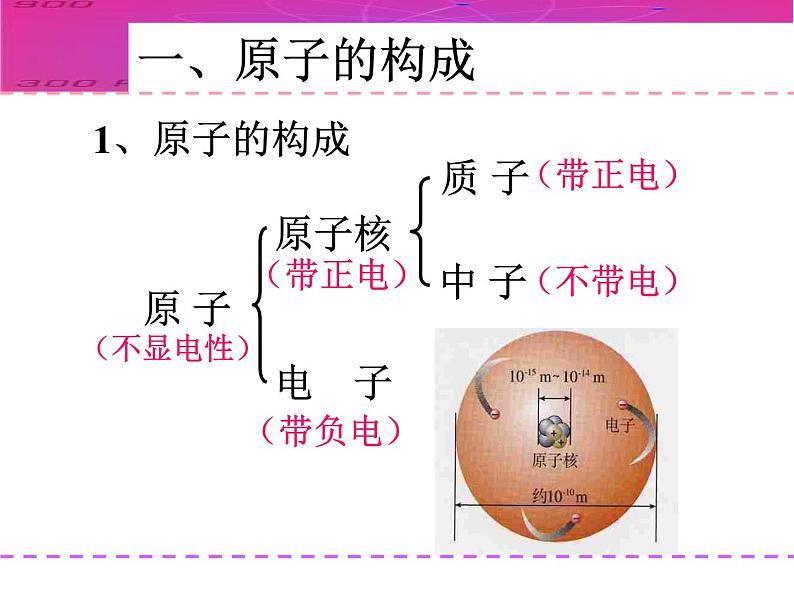
1.原子是由居于原子中心、带_____的原子核和核外带_____的电子构成,原子核是由_____和_____构成。由于它们所带的电荷_____,电性____,所以整个原子_____(填显或不显)电性。
2.能保持物质的化学性质的最小粒子是____;化学变化中的最小粒子是_____;原子中带正电荷的粒子是_ _________;不显电性的粒子有 、 、 。
3.据报道,1994年12月科学家发现了一种新元素,它的原子核内有111个质子, 161个中子,则该元素核外电子数是_____ 。
原子核的半径为原子半径的十万分之一
原子核的体积为原子体积的千亿分之一
原子核外的电子是如何运动的?
电子经常出现的区域叫电子层。
把电子在不同的区域内运动的现象叫做核外电子的分层排布
二 原子核外电子的排布
1、核外电子是分层排布的
电子层 一 二 三 四 五 六 七
(2)第一层最多排2个,第二层最多排8个;
(3)最外层最多排8个电子 (只有一个电子层时最多 2个电子);
(1)先 “里”后“外” .(能量最低原则)
2.核外电子分层排布的规律(仅限前3层)
(4)每个电子层最多容纳2n2个电子 (n代表电子层数).
3.原子结构示意图
画法:画圆圈,标核电,弧线呈扇面,数字一条线。
例如:O和P的原子结构示意图:
请按以下排列格式画出1~18号元素的原子结构示意图: H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
比一比,看一看你画对了吗?
1、“嫦蛾一号”的任务之一是探测月球上的氦-3资源,He-3的原子结构示意图为 ,图中x为( )。 A.1 B. 2 C. 3 D. 4
2.这是磷原子的结构示意图 ,该原子的核电荷数是__,共有__个电子层,第二电子层上有__个电子,最外层上的电子数是__。
3.已知碘元素(I)原子结构示意图为 ,则x 的值为__;
我们学习了原子的结构及原子结构示意图的画法,要熟练掌握1~18号元素的原子结构示意图画法并能灵活运用。
相关课件
这是一份初中人教版课题2 原子的结构多媒体教学课件ppt,共20页。PPT课件主要包含了化学变化,原子弹爆炸,秦山核电站,原子结构的发现历程,核外电子,原子核,核电荷,质子数即核电荷数,分组讨论,原子中等内容,欢迎下载使用。
这是一份化学九年级上册课题2 原子的结构说课课件ppt,共20页。PPT课件主要包含了原子及原子核的构成,原子的结构,中子不带电,原子电性,不显电性,不是所有原子都有中子,几种原子的构成,原子核外电子的排布,原子结构示意图,原子核等内容,欢迎下载使用。
这是一份初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构教案配套ppt课件,共51页。PPT课件主要包含了原子构成的规律,原子结构示意图,金属元素,非金属元素,Na+,氯化钠的形成,NaCl,构成物质的微粒,原子的稳定结构,课堂练习一等内容,欢迎下载使用。










