






2021-2022学年人教版化学中考复习之盐,化肥课件PPT
展开
这是一份2021-2022学年人教版化学中考复习之盐,化肥课件PPT,共60页。PPT课件主要包含了金属离子,NaCl,白色沉淀,Na2CO3,氢氧化钙,氯化钙,氯化钡,稀盐酸,小苏打,NaHCO3等内容,欢迎下载使用。
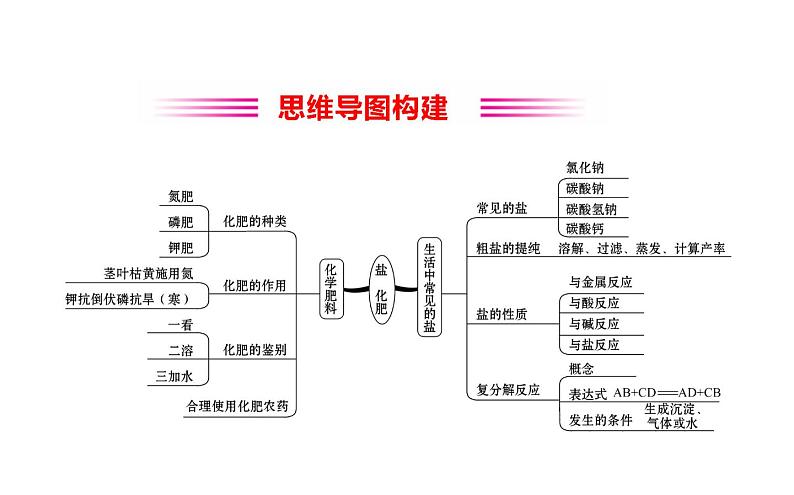
【主干回顾】一、盐1.盐的概念:由_____________(或_________离子)和_________离子构成的化合物。
【易错提醒】盐中不一定都含有金属离子,如铵盐中就不含金属离子。
2.常见盐的性质及用途(1)氯化钠①俗称:_________;化学式:_________; 物理性质:白色固体,有咸味,易溶于水;
②化学性质:水溶液呈_______性,能与硝酸银反应生成_____________; ③用途:调味剂、防腐剂、生理盐水配制和农业选种等。
(2)碳酸钠①俗称:_______________;化学式:__________; ②物理性质:白色固体,_______溶于水;
③化学性质:水溶液呈_______性;能与_____________或___________、___________溶液反应生成白色沉淀;能与_________ 反应生成气体; ④用途:玻璃、造纸、纺织和洗涤剂的生产等。
(3)碳酸氢钠①俗称:___________;化学式:__________; ②物理性质:白色固体,_______溶于水; ③化学性质水溶液呈_______性;能与___________反应生成气体;加热___________;
④用途:发酵粉、治疗胃酸过多等。(4)碳酸钙①俗称:___________或___________的主要成分;化学式:_________; ②物理性质:白色固体,不溶于水;
③化学性质:_________下可分解;能与_________ 反应生成气体; ④用途:重要建筑材料、补钙剂等。
3. 或 的检验(1)检验原理:组成里含有 或 的盐都能与_________反应生成_______气体,利用此反应可以检验盐的组成中是否含有 或 。
(2)检验试剂:___________和_______________。 (3)检验方法:取样 有_________产生 有______________________
白色沉淀(或浑浊)
【特别提醒】常见盐的溶解性记忆口诀:钾钠铵硝皆可溶,盐酸盐中银不溶,硫酸盐中钡不溶,其他碳酸盐都不溶。
【微点拨】 (1)复分解反应的特点:_________________(2)两种化合物反应生成另外两种化合物的反应不一定是复分解反应,如碱+非金属氧化物→盐+水的反应就不属于复分解反应,如2NaOH+CO2====Na2CO3+H2O。
三、化肥1.化肥的种类及作用:
2.不合理使用化肥、农药对环境的污染:(1)化肥:使用不当会污染土壤,造成土壤退化和水、大气环境污染。(2)农药:使用不当会对自然环境造成污染和对人体健康造成危害。
【微点拨】 铵态氮肥遇到熟石灰、草木灰等碱性物质,有氨气产生,从而降低肥效,因此铵态氮肥不可以与碱性肥料混合使用。
【核心反应】请以碳酸钠(Na2CO3)为中心,按照思路盘点并规范书写化学方程式。
①_________________________________________________________________________②___________________________________________________________
Na2CO3+H2SO4====Na2SO4+H2O+CO2↑
Na2CO3 +2HCl====2NaCl +H2O+ CO2↑
HCl+ NaOH====NaCl+ H2O
H2SO4 +2NaOH====Na2SO4 +2H2O
③_______________________________④______________________________________⑤________________________________________________________________________
2NaOH +CO2====Na2CO3 + H2O
Ca(OH)2 +Na2CO3====CaCO3↓ +2NaOH
Na2CO3+ BaCl2====BaCO3↓+ 2NaCl
Na2CO3+ CaCl2====CaCO3↓+ 2NaCl
⑥______________________________________________________________________________⑦___________________________________⑧_________________________________⑨_____________________________________
2NaHCO3 +H2SO4====Na2SO4+2H2O +2CO2↑
NaHCO3 + HCl====NaCl +H2O +CO2↑
2NaHCO3 Na2CO3 +H2O +CO2↑
NaCl +AgNO3====AgCl↓+ NaNO3
Na2SO4 + BaCl2====BaSO4↓+ 2NaCl
【自我测评】1.鉴定碳酸根离子的试剂最好是( )A.食盐水 B.盐酸和石灰水C.盐酸D.石灰水
2.在果实膨大拉长期的芒果需要大量补充氮、钾等元素。下列符合条件的一种化肥是( )A.KNO3B.Ca(H2PO4)2C.NH4NO3D.NH4H2PO4
3.(2018·梧州中考)关于碳酸钠的说法错误的是( )A.易溶于水 B.可用于洗涤油污C.受热易分解D.可用于制造普通玻璃
4.(2019·海南中考)在“粗盐中难溶性杂质的去除”实验中,不需要进行的操作是( )A.溶解 B.过滤 C.蒸发 D.蒸馏
5.(生活链接题)下列物质的用途错误的是( )
6.(2019·长沙模拟)以下说法正确的是( )A.酸中都含有氢元素,所以含有氢元素的化合物一定是酸B.二氧化碳能与水化合,因此气体都能与水发生化合反应
C.单质、氧化物、酸、碱、盐这五类物质均可以通过化学反应一步转化为盐D.复分解反应中,各元素化合价可能发生变化
7.下列化肥中,从外观即可与其他化肥相区别的是( )A.硫酸钾 B.硝酸钾 C.磷矿粉 D.氯化钾
8.(2019·安庆模拟)下面的各组固体,仅用水不能区分的一组是( )A.氢氧化钠和硝酸铵B.氯化钠和硫酸铜C.碳酸钙和硝酸钾D.氯化钠和氯化钙
9.(生活链接题)化学与我们的生活有着密切的联系。请从下列物质中选择相应的序号填空:①淀粉 ②纯碱 ③熟石灰 ④小苏打 ⑤硝酸钾 (1) 可作复合肥的是________(2)可用来治疗胃酸过多症的一种药剂是________
(3)可用来改良酸性土壤的是________(4)米和面中含有的糖类物质主要是________
10.填写实验报告。【实验目的】探究复分解反应的条件。【实验过程】
【实验结论】(1)硝酸钡溶液和稀硫酸反应的化学方程式为__________________________________。 (2)两种化合物互相交换成分,生成物中有____________________生成时,复分解反应才可以发生。
Ba(NO3)2+H2SO4====BaSO4↓+2HNO3
11.“宏观-微观-符号”三重表征是化学独特的表示物质及其变化的方法。请结合图示回答下列问题:
将Ca(OH)2固体溶于水配成溶液,滴入Na2CO3溶液进行实验。(1)碳酸钠固体俗名_______________。 (2)图1反应的实验现象是___________________。反应的化学方程式为___________________________________。
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
(3)图2是反应的微观示意图,根据图示判断反应前后离子没有变化的是____________;仿照中和反应可以用H++OH-====H2O的形式表达,试写出该反应的表达式 ________________________。
Ca2++ ====CaCO3↓
(4)根据所学,推测能够与澄清石灰水发生上述反应的物质还有_________(写一种物质的化学式)。
命题点一 盐的化学性质【典例1】(2019·临沂中考)盐中含有金属离子(或 )和酸根离子,组成相似盐具有一些相似的化学性质。.
(1)硫酸铜、硝酸铜两种物质的溶液均显_______色。因为它们都具有相同的铜离子。向这两种物质的溶液中分别加入NaOH溶液,有相同的实验现象发生,写出其中一个反应的化学方程式 ______________________________________________________________________。
CuSO4+2NaOH====Cu(OH)2↓+Na2SO4
[或Cu(NO3)2+2NaOH====Cu(OH)2↓+2NaNO3]
(2)向硫酸铜、硝酸铜两种物质的溶液中分别加入BaCl2溶液,能发生反应的物质是_________(填化学式),另外一种物质不反应。 (3)向硫酸铜溶液中,加入某纯净物的溶液,能同时将铜离子和硫酸根离子转变成沉淀,该纯净物的化学式为 _________。
【特别提醒】解答这类题目要熟悉盐的溶解性和盐的化学性质1.常见盐的溶解性钾盐、钠盐、铵盐、硝酸盐都溶于水,硫酸盐中只有硫酸钡不溶,硫酸钙、硫酸银微溶,盐酸盐(即氯化物)中只有氯化银不溶,碳酸盐大多数不溶于水(碳酸钾、碳酸钠、碳酸铵可溶)。
【题组过关】1.(2019·郴州中考)下列各组物质在溶液中发生反应,生成白色沉淀的是( )A.NaOH与稀硫酸 B.CaCO3与稀盐酸C.CuSO4与KOHD.AgNO3与NaCl
2.(2019·遂宁中考)一包白色粉末可能含有KNO3、CuCl2、KCl、BaCl2中的一种或几种。为验证其成分,做如下实验:.(1)取样加入适量水完全溶解,溶液呈无色;
(2)将(1)所得溶液平均分成两份,向其中一份滴加硫酸钠溶液,无沉淀产生;(3)向另一份滴加硝酸银溶液,有白色沉淀产生。
据此分析:①原白色粉末的组成是_____________或________; ②产生沉淀的化学方程式为____________________________。
KCl+AgNO3====AgCl↓+KNO3
命题点二 复分解反应及其应用【典例2】(2019·湘潭中考)能在pH=3的溶液中大量共存,且溶液无色透明的一组离子是( )
A.K+、Na+、Cl-、 B.Mg2+、OH-、 、Cl-C.Na+、 、 、 D.Ca2+、Cu2+、Cl-、
【方法点拨】不能共存的离子对(1)强酸性溶液(H+)中不能大量存在OH-、 、 等。(2)强碱性溶液(OH-)不能和 、Mg2+、Al3+、Fe3+、Cu2+等大量共存。
(3)能相互结合生成难溶性物质的离子不能大量共存:Ba2+与 、Ag+与Cl-、Ca2+与 、Ba2+与 等。
【题组过关】1.(2019·临沂中考)下列物质混合,能发生化学反应且现象不明显的是( )A.铝与硫酸铜溶液B.氢氧化钠溶液与稀盐酸C.澄清石灰水与纯碱溶液D.硫酸钠溶液与氯化铜溶液
2.(2019·十堰中考)在无色溶液中,下列各组物质能大量共存的是( )A.氯化钠、氢氧化钙、稀盐酸B.硝酸钾、氯化铜、氢氧化钠C.硝酸钠、氢氧化钾、氯化钡D.碳酸氢钠、氯化钾、稀硫酸
3.(2019·泰安中考)某化学兴趣小组对A、B、C、D四种未知溶液的成分进行了检验,检验结果见下表。其中检验结果不正确的是( )
实验 粗盐中难溶性杂质的去除1.实验原理依据物质的溶解性不同,利用__________的方法除去食盐中的泥沙等不溶性杂质,然后_______ 水得到较纯的精盐。
4.误差分析(1)造成产率偏低的原因可能有①溶解过程中食盐未完全溶解;②过滤时液体溅出或倾倒不彻底或过滤不彻底;③蒸发时造成液体或固体飞溅;④器皿上沾有的精盐没全部转移到称量纸上。
(2)造成产率偏高的原因可能有①称量时多称了;②蒸发时未充分蒸干。
【典例】(2019·滨州中考)结合下图仪器,完成粗盐提纯实验中的有关问题。
(1)仪器①的名称是___________。 (2)在过滤粗盐水时,除用到⑤⑥⑦⑧,还需要用到图中的一种玻璃仪器是_________(填名称)。 (3)蒸发结晶食盐,除用到①②⑧⑨,还需用到图中的仪器有_______(填序号)。
(4)下列有关蒸发结晶操作描述正确的是______。 A.当加热至有晶体析出时,即停止加热B.当蒸发皿中出现较多固体时,即停止加热C.当水分完全蒸干时,即停止加热D.蒸发皿应放在石棉网上加热,防止破损
【拓展延伸】除去粗盐中可溶性杂质的方法
(1)操作中加入过量药品的目的是将杂质除净。(2)过量的碳酸钠溶液既除去粗盐中的钙离子,也除去过量的钡离子,因此,加入药品时,碳酸钠溶液必须加在氯化钡溶液之后。
相关课件
这是一份盐和化肥-中考化学一轮复习课件PPT,共27页。PPT课件主要包含了盐化肥,思维导图,真题演练,LiOH溶液,CO2,试管中没有物质残留,试管中有物质残留,NH4Cl,金属离子,小苏打等内容,欢迎下载使用。
这是一份盐 化肥-中考化学一轮复习课件PPT,共35页。PPT课件主要包含了知识网络·思维导图,知识清单·主干回顾,几种常见的盐,小苏打,白色固体,酸根离子,常见盐的化学性质,复分解反应,化合物,另外两种化合物等内容,欢迎下载使用。
这是一份盐 化肥-中考化学一轮复习课件PPT,共60页。








