





高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教学演示ppt课件
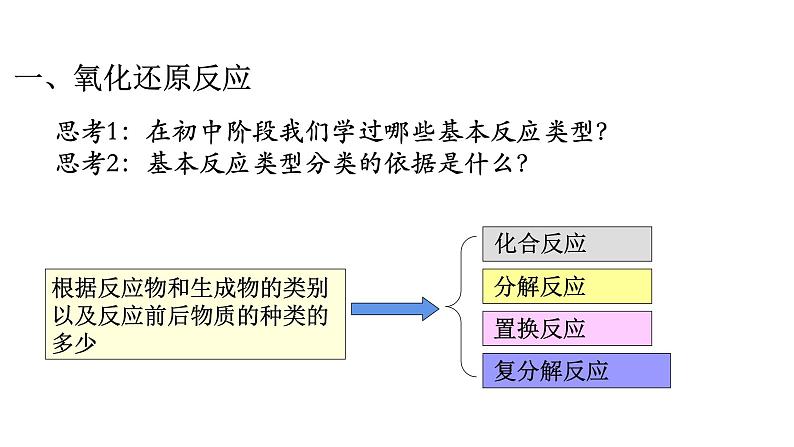
展开思考1:在初中阶段我们学过哪些基本反应类型? 思考2:基本反应类型分类的依据是什么?
根据反应物和生成物的类别以及反应前后物质的种类的多少
该反应属于哪种基本反应类型?
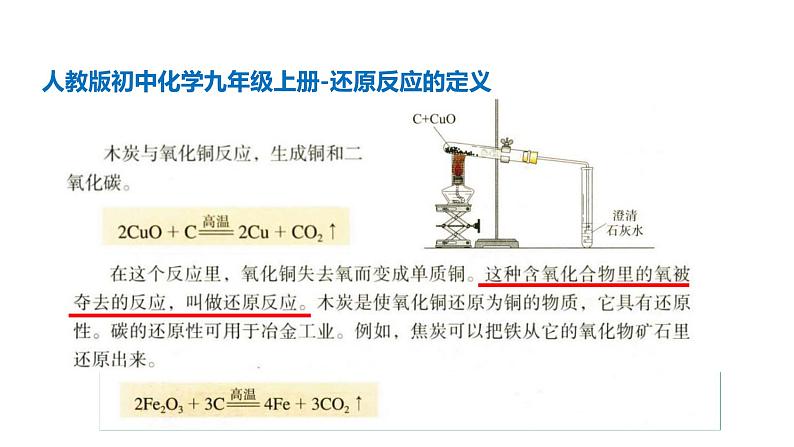
人教版初中化学九年级上册-还原反应的定义
初中对氧化反应和还原反应的定义
分类依据:氧元素的得失
氧化还原反应:氧化反应和还原反应是在同一个反应中同时发生的,对立统一的。
C的角度:得到氧,发生氧化反应。
CuO的角度:失去氧,发生还原反应。
氧化反应和还原反应是分别独立进行的吗?为什么?
下列氧化还原反应中各种元素的化合价在反应前后有无变化? 讨论氧化还原反应与元素化合价的升降有什么关系?
+2 0 0 +4
+1 0 0 +2
+2 0 0 +1
结论2:物质所含元素化合价升高的反应是氧化反应物质所含元素化合价降低的反应是还原反应
有元素化合价升降的化学反应是氧化还原反应
氧化还原反应的判断依据:是否有元素化合价升降
【学以致用】分析反应: H2+Cl2 = 2HCl Fe + CuSO4 = FeSO4 + Cu 2Na+Cl2 = 2NaCl 是不是氧化还原反应,为什么?
思考:在氧化还原反应中,元素化合价发生改变的本质原因是什么?
氯原子, 1个电子,生成 ,化合价 ,发生 反应。钠原子, 1个电子,生成 ,化合价 ,发生 反应。
氯原子,共用电子对 ,化合价 ,发生 反应。氢原子,共用电子对 ,化合价 ,发生 反应。
氧化还原反应的本质:电子转移(得失或偏移)
氧化还原反应是电子发生转移(得失或偏移)的反应
氧化反应:失去电子(或共用电子对偏离)的反应还原反应:得到电子(或共用电子对偏向)的反应
规律:升、失、氧;降、得、还
由两种或两种以上的物质,形成一个成分较复杂的化合物的反应。
一种单质和一种化合物生成另一种单质和另一种化合物的反应。
Na2O+CO2===Na2CO3
2Na+2Cl2===2NaCl
氧化还原反应与四种基本反应类型的关系
通式A+BC===C+AB
Zn+2HCl===H2↑+ZnCl2
一种化合物分解成二种或二种以上较简单的单质或化合物的反应。
CaCO₃===CaO+CO₂
2KClO3===2KCl+3O2
由两种化合物互相交换成分,生成另外两种化合物的反应。
通式AB+CD===AD+CB
2HCl+CaCO₃=CaCl₂+H₂O+CO₂
氧化还原反应中电子转移的表示方法
例 2Na + Cl2==== 2NaCl
2Na + Cl2=== 2NaCl
失去2× e- ,化合价升高
得到2× e- ,化合价降低
例 Zn + Cu2+ ══ Zn2+ + Cu
Zn + Cu2+ ══ Zn2+ + Cu
在化学反应中,有元素化合价升降,即电子转移的 化学反应是氧化还原反应。
发生电子转移
1、下列反应属于氧化还原反应的是( )A. CuO+2HCl=CuCl2+H2O B. 2Na2O2+2H2O=4NaOH+O2↑C. Zn+CuSO4=ZnSO4+Cu D. Ca(OH)2+CO2=CaCO3↓ + H2O
2、下列四种基本类型的反应中,一定是氧化还原反应的是( )A. 化合反应 B. 分解反应C. 置换反应 D. 复分解反应
3、下列叙述正确的是( )A. 在氧化还原反应中,失去电子的物质,所含元素化合价降低B. 凡是有元素化合价升降的化学反应都是氧化还原反应C. 在氧化还原反应中一定所有的元素化合价都发生变化D. 氧化还原反应的本质是电子的转移(得失或偏移)
第3节 氧化还原反应
1.氧化剂和还原剂的概念
所含元素的化合价降低的反应物
所含元素的化合价升高的反应物
2.氧化产物和还原产物
氧化产物:还原剂失电子后得到的产物
还原产物:氧化剂得电子后得到的产物
Cu + Cl2 ==== CuCl2Zn + H2SO4 ==== ZnSO4 + H2↑Cl2 + H2O==== HCl + HClO
下列反应中,哪些是氧化剂?哪些是还原剂?哪些是氧化产物?哪些是还原产物?
既是氧化产物又是还原产物
既是还原剂又是氧化剂
特别提醒:得失电子的难易程度与得失电子多少没有关系
H2S S SO2 H2SO3 Na2SO3 H2SO4(浓)
-2 0 +4 +4 +4 +6
三、化合价高低与氧化性、还原性的关系
既具有氧化性又具有还原性
【想一想】判断下列物质具有氧化性还是还原性。
口诀:高价氧化(性)、低价还原(性)、中间价态两性全。
总结归纳:含有最高价态的元素的物质具有氧化性;含有最低价态的元素的物质具有还原性;含有中间价态的元素的物质既有氧化性又有还原性。
【小结】氧化还原反应中各概念之间的关系
记忆口诀:失(失电子)升(价升高)氧化(氧化反应 被氧化 得到氧化产物)还原剂
F2 Cl2 Br2 O2
K Na Mg Al H2 C Fe
Fe2O3 CuO H2O2 Na2O2
HClO HNO3 浓H2SO4
KClO3 FeCl3 KMnO4
浓盐酸 H2S HI H2SO3
FeCl2 Na2SO3
Fe2+ S2- SO32-
四、常见的氧化剂与还原剂
Fe3+ MnO4-
五、氧化性、还原性的强弱比较方法
1、根据氧化还原反应方程式进行比较
氧化剂 还原剂 还原产物 氧化产物
氧化性:氧化剂 > 氧化产物 即:MnO2 > Cl2还原性:还原剂 > 还原产物 即:浓盐酸 > MnCl2
2、根据同一种元素的化合价进行比较
①元素处于高价只有氧化性,处于低价只有还原性,处于中间价态既有氧化性又有还原性。
②一般的,对于同一种元素价态越高氧化性越强,价态越低还原性就越强。eg: Fe Fe2+ Fe3+
注:含有不同价态的同种元素的化合物间发生反应时,同种元素高价与低价之间发生归中反应。 eg:H2S +H2SO4(浓) = S + SO2 + 2H2O“ 只靠拢,不交叉”
3、根据单质的活动顺序进行比较
②根据非金属活动性顺序
注:金属之间发生置换反应,还原性强的可以置换出还原性弱的, 非金属之间发生置换反应,氧化性强的可以置换出氧化性弱的。
4、根据反应的难易程度进行比较
与同一种物质发生氧化还原反应时,反应条件越容易,一般可说明物质的氧化性或还原性越强。
结论:KMnO4 > MnO2
5、根据“二度”(酸碱度 浓度)进行比较
①浓度 其他条件不变时,一般物质的浓度越大起氧化性就越强。 eg:铜不与稀硫酸反应但是可以和浓硫酸反应
②酸碱度 MnO4- 、NO3-的氧化性与H+浓度有关,H+浓度越大其氧化性越强
6、根据物质所含元素化合价变化的高低进行比较
eg: 2Fe + 3Cl2 = 2FeCl3 Fe + S = FeSS只能将Fe 氧化为+2价,Cl却能将Fe氧化为+3价,因此氧化性:Cl > S
六、氧化还原反应方程的配平
1. 质量(原子)守恒原则 即反应前后各元素的原子个数相等2.电子守恒原则 反应中还原剂失去电子的总数与氧化剂得到的电子总数相等(即化合价升降总数相等)3.电荷守恒原则 即在离子反应中,反应前后离子所带的正负电荷总数相等如: Fe + 2 Fe3+ = 3 Fe2+
n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值
化合价口诀一价氢氯钾钠银 二价氧钙镁钡锌 三铝四硅五价银 二三铁,二四碳 二四六硫都齐全 铜汞二价最常见单质零价永不变
特殊物质:NaH(H-1)、 NaBH4(H-1) Na2O2(O-1)、 HClO(Cl-1) K2FeO4(Fe+6) 、 CaC2(C-1) Na2S2O3(S+2) 、 FeS2(Fe+2 S-1) Cu2S(Cu+1 S-2)
0 +5 +4 +4
求化合价升降的最小公倍数,使化合价升高和降低的总数相等。
1 4 4 1 2
H2S + HNO3 S + NO + H2O
NH3 + O2 N2 + H2O
【注】部分氧化还原反应 化学计量数分两部分:作氧化剂或还原剂和参加非氧化还原反应的 。
(1)适用对象:部分氧化还原反应;自身氧化还原反应(包括歧化反应)。
(2)方法:从右边生成物着手配平,即:选择氧化产物、还原产物为基准物质
例 KMnO4 + HCl — KCl+ MnCl2+ H2O+ Cl2↑
+7 -1 +2 0
Cl2 + KOH — KCl + KClO3 + H2O
【练习2】配平下列化学方程式:
Cu + HNO3(稀)— Cu(NO3)2+ NO↑ + H2O
0 +5 +2 +2
S + KOH — K2S + K2SO3 + H2O
NH4NO3 — HNO3 + N2 + H2O
某些反应物或生成物分子内有两种或两种以上元素的化合价发生变化 ,可将分子看作一个整体作为基准物质进行配平。
【例】 FeS2 + O2 — Fe2O3 + SO2
+2-1 0 +3 -2 +4-2
此反应还可用“奇数配偶法”或“分数法”配平。
“奇数配偶法”就是反应中出现次数较多的元素在化学方程式原子个数两边出现一奇一偶的现象,则把奇数个原子配成最小的偶数2,再用观察法配平。
FeS2 + O2 — Fe2O3 + SO2
适用于复杂的物质,化合物中元素的化合价无法确定。
方法:令化合价的物质中各元素均为零价,然后利用整体法计算出化合价总升、降值,进行配平,再观察配平其他物质的系数。
【例】 Fe3C + HNO3 — Fe(NO3)3+ CO2↑ + NO2↑+ H2O
Pt + HNO3+ HCl — H2PtCl6 + NO↑+
①先配氧化剂、还原剂及还原产物与氧化产物;
②再根据质量守恒、电荷守恒确定所缺的物质的化学式(分子或离子),缺项一般是酸、碱或水。
③最后观察配平其他物质系数。
比较两边H、O原子个数不等,可见生成物中含有H、O元素,再比较反应物比生成物多8个O、16个H,故知生成物为H2O,水的系数为8。
Cr(OH)4- + + ClO-— CrO42- + Cl- + H2O
高中人教版 (2019)第三节 氧化还原反应教课ppt课件: 这是一份高中人教版 (2019)第三节 氧化还原反应教课ppt课件,共16页。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教案配套ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教案配套ppt课件,共23页。PPT课件主要包含了课前思考,思考与交流1,分类标准得氧失氧,氧化反应,还原反应,氧化还原反应,得到氧化反应,失去氧还原反应,化合价升高,化合价降低等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应精品课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应精品课件ppt,共30页。PPT课件主要包含了氧化反应,物质得到氧的反应,还原反应,物质失去氧的反应,氧化还原反应,化学反应的分类,非氧化还原反应,置换反应,化合反应,分解反应等内容,欢迎下载使用。












