






人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料图片ppt课件
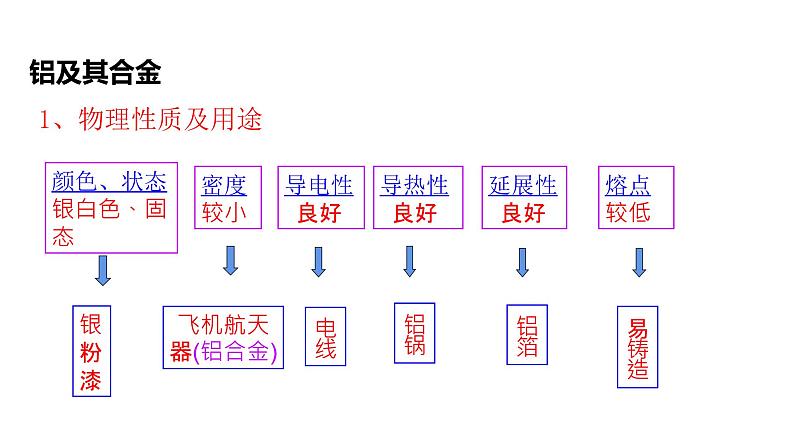
展开颜色、状态银白色、固态
(1)与非金属单质反应
①常温下,铝被空气中的氧气氧化生成致密的氧化物膜,该膜会阻止内部继续反应,因此,铝制品比铁制品更耐腐蚀。
剧烈燃烧,放出大量的热和耀眼的白光。
应用:制造燃烧弹、信号弹、火箭推进剂
(2)与某些金属氧化物反应(铝热反应)
说明:除氧化铁外,V2O5 Cr3O4 MnO2 CuO FeO Fe3O4 WO3 TiO2 C3O4 等也可以发生铝热反应。
①常温下,与浓硝酸、浓硫酸发生钝化。
②与氧化性的酸(稀硝酸) Al + 4HNO3 = Al(NO3)3 + NO↑ +2H2O
③与非氧化性的酸(盐酸、稀硫酸) 2Al + 6H+ = Al3+ + 3H2↑
2Al+2 NaOH+2H2O=2NaAlO2+3H2↑
离子反应方程式: 2Al + 2 OH- + 2H2O =2 AlO2- + 3H2↑
2Al+3CuSO4 = 3Cu+Al2(SO4)3
2Al+Fe2(SO4)3 = 2Fe+Al2(SO4)3
Al+3AgNO3 = 3Ag+Al(NO3)3
1、氧化铝[ Al2O3 ]
(1)存在:自然界中纯净的氧化铝俗称刚玉、含铝矿物质铝土矿(2)物理性质:白色固体 硬度高 熔点高 难溶于水
(3)化学性质: ①与强酸反应:Al2O3 +6H+=2Al3++3H2O ②与强碱反应:Al2O3 +2OH- = 2Al O2 - + H2O两性氧化物:像这样既能与酸又能与碱反应生成盐和水的氧化物。
(4)用途:耐火材料,冶炼铝,其它刚玉、红蓝宝石等
Al(OH)3+3H+=Al3++3H2O Al(OH)3 + OH- = AlO2- +2H2O
2、氢氧化铝[ Al(OH)3 ]
(1)物理性质:白色胶状沉淀,具有吸附性
两性氢氧化物:既能与强酸反应,又能与强碱反应。
不稳定性: 2Al(OH)3 = Al2O3 + 3H2O
(4)用途:用于凝聚水中的悬浮物和吸附色素可用作净水剂:明矾作为胃酸中和剂:胃舒平
(3)制备:a.可溶性的铝盐和氨水反应b.偏铝酸盐溶液中通入足量的二氧化碳
3、偏铝酸盐AlO2-
(1)与强酸反应 ①酸不足时:AlO2- + H+ + H2O = Al(OH)3 ②酸过量时:AlO2- + 4H+ = Al3+ + 2H2O
(2)与CO2反应 ① CO2不足或适量时: 2AlO2- + CO2 + 3H2O = 2Al(OH)3 + CO32- ② CO2过量时: AlO2- +CO2 + 2H2O = Al(OH)3 + HCO3-
Al2O3Fe2O3SiO2
AlCl3FeCl3HCl溶液
NaAlO2NaClNaOH溶液
NaAlO2Na2SiO3NaOH溶液
AlCl3NaClHCl溶液
除了传统的合金材料以外,随着科技的发展,人们合成了很多具有特殊性能的新型合金
氢气是一种易燃易爆的气体,所以利用氢气的主要问题在于如何进行安全存储和运输。储氢合金是一类能够大量吸收氢气并与氢气结合成金属氢化物的材料。该材料受热又会分解放出氢气,常见的储氢合金是Ti- Fe、La-Ni等。
物质的量在化学方程式计算中的应用
2Na + 2H2O = 2NaOH + H2↑
扩大6.02×1023倍
2×6.02×1023
1×6.02×1023
化学计量数之比,等于各物质的粒子数之比,也等于各物质的物质的量之比
进行物质的量应用于化学方程式的计算时,须按以下步骤进行 ① 写出有关反应方程式 ② 找出相关物质的化学计量数之比 ③ 对应化学计量数,找出相关物质的物质的量的关系④ 根据物质的量的关系,按照比例相等模式进行计算
【例题】完全中和0.1 ml NaOH需H2SO4的质量是多少?
【解】2NaOH +H2SO4 = Na2SO4 + 2H2O
答:所需H2SO4的质量是4.9g
物质的量应用于化学方程式计算的一般步骤,可以简单总结为四步:写方程式、落系数、成比例、算结果。
【练习】0.4ml钠与足量的水反应,求:(1)生成H2的质量 (2)生成NaOH的质量
2Na + 2H2O == 2NaOH + H2↑
2ml 0.4ml
得n(NaOH)=0.4ml
得n(H2)=0.2ml
2mln(NaOH)
答:(1)生成H2的质量为0.4g (2)生成NaOH的质量为16g
得m(NaOH)=16g
得m(H2)=0.4g
80gm(NaOH)
注:只要上下单位一致,左右关系对应,则可列比例式计算
【例题】250mL 2ml/L的硫酸与足量的铁完全反应。计算:(1)参加反应的铁的物质的量;(2)生成的氢气在标准状况下的体积。
Fe + H2SO4 == FeSO4 + H2↑
1 n(Fe)
n(Fe)=0.50ml
10.50ml
参加反应的硫酸的物质的量为:0.25L×2ml/L=0.50ml
V(H2)=11.2L
22.4LV(H2)
【练习】将2.70g Al投入足量的NaOH溶液,求:(1)参加反应的NaOH的物质的量 (2)生成H2的体积(标准状况下)
2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑
2×27g 2.7g
3×22.4L V(H2)
得n(NaOH)=0.1ml
得V(H2)=3.36L
答:(1)参加反应的NaOH的物质的量为0.1ml (2)生成H2的体积(标准状况下) 为3.36L
解: Fe + H2SO4 == FeSO4 + H2↑
m (Fe) n (H2SO4) n (FeSO4) 2.24L
56g 1ml 1ml 22.4L
答: H2SO4的物质的量为0.1ml; Fe的质量为5.6g;FeSO4的浓度为0.2ml/L.
【练习】用一定量的Fe与足量的1ml/L的H2SO4溶液反应来制取H2。若要制得2.24L H2(标况),试计算(1)参加反应的H2SO4的物质的量。(2)参加反应的Fe的质量。(3)所得FeSO4的物质的量。(4)若将反应后的溶液稀释到500ml,则FeSO4的物质的量浓度是多少?
2、物质的量在化学方程式计算中的应用
储氢合金、耐高温合金、记忆合金、高强度合金、生物性能合金等
进行物质的量应用于化学方程式的计算时,须按以下步骤进行: ①写出有关反应方程式 ②找出相关物质的化学计量数之比 ③对应化学计量数,找出相关物质的物质的量的关系④根据物质的量的关系,按照比例相等的模式进行计算
上下单位一致,左右关系对应
化学计算中的三种常用方法一、关系式法当已知物和未知物之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。(1)根据化学方程式确定关系式写出发生反应的化学方程式,根据量的关系写出关系式。
如:把CO还原Fe2O3生成的CO2通入到澄清石灰水中,求生成沉淀的量。发生反应的化学方程式:3CO+Fe2O3 2Fe+3CO2,CO2+Ca(OH)2=CaCO3↓+H2O。则关系式为3CO~3CO2~3CaCO3,即CO~CaCO3。(2)根据原子守恒确定关系式上述例子中也可直接根据碳原子守恒得出CO~CaCO3。
人教版 (2019)必修 第一册第一节 铁及其化合物复习ppt课件: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物复习ppt课件,共21页。PPT课件主要包含了图解激光打印机原理,沉淀法,是否有Fe3+剩余等内容,欢迎下载使用。
化学人教版 (2019)第二节 金属材料教课ppt课件: 这是一份化学人教版 (2019)第二节 金属材料教课ppt课件,共20页。PPT课件主要包含了生活中常见的铝制品,铝的物理性质,铝的原子结构示意图,常温下被O2氧化,先沉淀后不溶解,碱性比氨水弱,酸性比碳酸更弱,制备氢氧化铝,Al2O3Fe2O3,Fe2O3固体等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 金属材料说课ppt课件: 这是一份人教版 (2019)必修 第一册第二节 金属材料说课ppt课件,共19页。PPT课件主要包含了纯金属单质和合金,物理变化,混合物,铁合金,钢铁直男,合金钢,碳素钢,不锈钢,课堂小练,新型合金等内容,欢迎下载使用。














