






高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表背景图课件ppt
展开春秋战国时期,墨子、惠子等哲学家同样从不同角度提出了物质有不能再分的最小单位的观点。
公元前450年以前,古希腊哲学家德谟克利特提出,宇宙万物都是由最微小、坚硬、不可入,不可分割的物质粒子所构成的。这种粒子就是原子。
道尔顿模型(1803年)
原子是构成物质的基本粒子,它们是坚实的、不可分割的实心球体
1904年,英国物理学家汤姆孙提出:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
卢瑟福原子模型:行星模型
1911年,物理学家卢瑟福提出:在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星围绕太阳运转一样。
1913年,玻尔原子结构模型
玻尔原子模型:电子在原子核外空间的一定轨道上绕核做高速圆周运动。
1926年,奥地利物理学家薛定谔等以量子力学为基础提出电子云模型
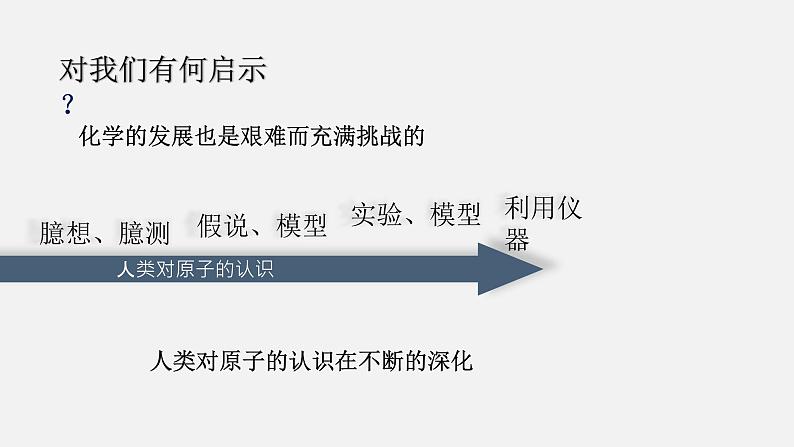
电子云模型:现代物质结构学说。电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。目前,科学家已经能利用电子显微镜和扫描隧道显微镜摄制显示原子图像的照片。随着现代科学技术的发展,人类对原子的认识过程还会不断深化
人类对原子的认识在不断的深化
化学的发展也是艰难而充满挑战的
与物质化学性质密切相关
核电荷数=质子数=核外电子数=原子序数
2.质量数原子的质量主要集中在 上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值即为 ,用符号 表示。 3.两个等式关系①原子序数=核电荷数=质子数=核外电子数(原子中的数量关系)②质量数(A)= + (质量关系)
质量数(A)=质子数(Z)+中子数(N)
在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。
5、核外电子排布的一般规律——“一低四不超”
1、能量规律——能量最低原理:
核外电子总是先排布在能量较低的电子层里,然后由里向外,依次排布在能量逐渐升高的电子层
2、数量规则——四不超:
(1)每层最多容纳电子数为2n2
(2)最外层不超过8个电子(K层为最外层时不超过2个电子)
(3)次外层不超过18个电子
(4)倒数第三层不超过32个电子
注:以上规律是相互联系,不能孤立地理解。
6、原子结构示意图以钠原子结构示意图为例
离子结构示意图离子结构示意图中各符号与原子结构示意图含义一样,但注意原子结构示意图中质子数等于核外电子数,而离子结构示意图中质子数与核外电子数不相等。如:Cl- ;Na+ 。
电中性微粒(分子或原子):质子数=核外电子数=核电荷数。 阳离子Xm+:质子数= 。 阴离子Xm-:质子数= 。
7、核电荷数为1-18的原子结构示意图如下,你从中获取哪些信息?
元素的化学性质与其原子的最外层电子数有关。(原子最外层电子数相同,其化学性质相似,氢和氦除外)
(1)当原子最外层电子数达到8(氦为2)时,该原子处于稳定结构,化学性质较稳定。
(2)一般来讲原子最外层电子数小于4时,易失去电子,表现为金属性;原子最外层电子数大于4时,易得到电子,表现为非金属性;原子最外层电子数等于4时,既不易失去也不易得到电子。
8.常见的2电子微粒10电子微粒和18电子微粒
(1)核外有2个电子的粒子 ①分子:He、H2;②离子:H-、Li+
(2)核外电子总数为10的粒子①原子:Ne;②阳离子:Na+、Mg2+、Al3+、H3O+;③阴离子:N3-、O2-、F-、OH-、 ;④分子:CH4、NH3、H2O、HF
(3)核外电子总数为18的粒子①原子:Ar;②阳离子:K+、Ca2+;③阴离子:P3-、S2-、HS-、Cl-;④分子:F2、H2O2、H2S、HCl、PH3、SiH4等
“10电子微粒”和“18电子微粒”的推导(1)10电子微粒
9、1-20号元素的原子特点
1. 某元素的原子核外有三个电子层,M层的电子数是L层电子数的 1/2,则该元素的原子是( ) A.LiB.Si C.Al D.K2.下面关于多电子原子核外电子的运动规律的叙述正确的是( ) A.核外电子是分层运动的 B.所有电子在同一区域里运动 C.能量高的电子在离核近的区域运动 D.能量低的电子在离核远的区域绕核旋转
原子序数= = = 。
2、现行元素周期表的编排原则
按照元素在周期表中的顺序给元素编号,得到原子序数。
把电子层数相同的元素,按原子序数递增顺序从左到右排列
把最外层电子数相同的元素,按电子层数递增的顺序自上而下排列
具有相同电子层数而又按照原子序数递增顺序由左往右排列的一横行元素称为一周期。
不同横行中最外层电子数相同的元素按电子层数递增的顺序由上到下排成纵列称为族。
第2周期:8 种元素
第4周期:18 种元素
第5周期:18 种元素
第6周期:32 种元素
(15 种元素称镧系元素)
(15 种元素称锕系元素)
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA 、ⅦA
ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB
三个纵行,于Ⅶ B 与ⅠB间
元素周期表排列顺口溜(1)七个横行七周期,二八十八三十二。第六周期有镧系,锕系元素在第七。纵行花开十八朵,主族副族均占七。第Ⅷ族三列八九十,0族元素是气体。
(2)横行叫周期,现有一至七;三四分长短,四常副族现;纵行称作族,共有十六族;二、三分主副,先主后副族;VIII族最特殊,三行是一族;二次分主副,副后是主族。一八依次现,一零再一遍。锕、镧各十五,均属IIIB族。
记住:前36号元素、零族和所有主族
确定元素在元素周期表中的位置
2.利用“0族定位法”确定元素在周期表中的位置
①零族元素的周期序数和原子序数
②比大小定周期比较该元素的原子序数与0族元素的原子序数的大小,找出与其相邻近的两种0族元素,那么该元素就和原子序数大的0族元素处于同一周期。
如:已知第六周期稀有气体的原子序数是86,请写出第82号元素位于 。
③求差值定族数若某元素原子序数比相应0族元素多1或2,则该元素应处在0族元素所在周期的下一个周期的ⅠA族或ⅡA族;若比相应的0族元素少1~5时,则应处在同周期的ⅦA~ⅢA族。若是其它值,则由差值按16族的顺序找对应族。如第11号元素位于 ;第32号元素 。
3.利用“阴上阳下”规律推断
4.同一主族相邻周期元素的原子序数差值问题。
对于第ⅠA、ⅡA族而言,相邻周期元素的原子序数相差的数值等于上一周期所含元素的种类数。如第ⅡA族,第三周期(12号)和第四周期元素(20号)的原子序数相差的数值等于第三周期所含元素的种类数,为8。对于第ⅢA~ⅦA族元素而言,相邻周期元素的原子序数相差的数值等于下一周期所含元素的种类数。如第ⅦA族,第三周期(17号)和第四周期元素(35号)的原子序数相差的数值等于第四周期所含元素的种类数,为18。
“一二为上,三七为下”
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一种元素的不同原子互称为 同位素。即同一元素的不同核素之间互称为同位素。
应用:(1)14C在考古工作中用于测定文物的年代。(2) 235U用于制造原子弹和核发电。(3)2H、 3H用于制造氢弹(4)放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
化学选择性必修2第一章 原子结构与性质第二节 原子结构与元素的性质课文内容ppt课件: 这是一份化学选择性必修2第一章 原子结构与性质第二节 原子结构与元素的性质课文内容ppt课件,共48页。PPT课件主要包含了元素周期律,元素周期系,元素周期表,门捷列夫周期表,短式周期表,维尔纳的特长式周期表,第八周期,变变变,思考与讨论,对角线规则等内容,欢迎下载使用。
化学必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表备课课件ppt: 这是一份化学必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表备课课件ppt,共42页。PPT课件主要包含了核外电子,负电荷,质子数Z,中子数N,能量不同,不连续的壳层,能量最低,能量逐步升高等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 原子结构与元素周期表优质ppt课件: 这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表优质ppt课件,文件包含41原子结构与元素周期表ppt、化学元素周期表门捷列夫之歌_超清mp4、实验4-1卤素间的置换反应mp4、探究碱金属化学性质的比较mp4、最大的化学实验碱金属单质与水的反应视频mp4等5份课件配套教学资源,其中PPT共39页, 欢迎下载使用。













