

高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表课文ppt课件
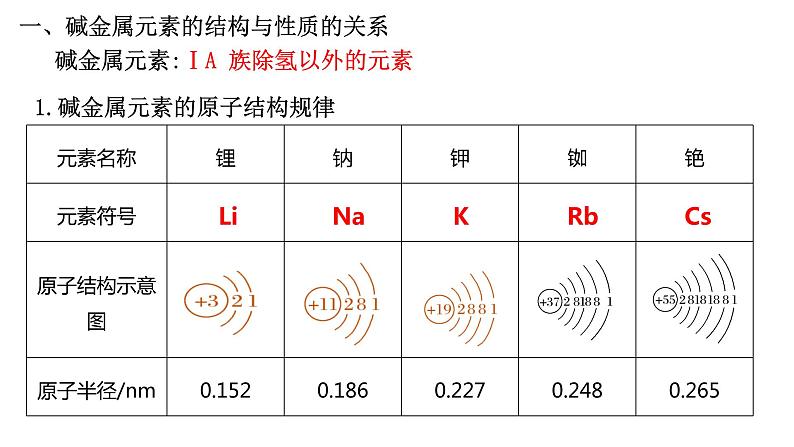
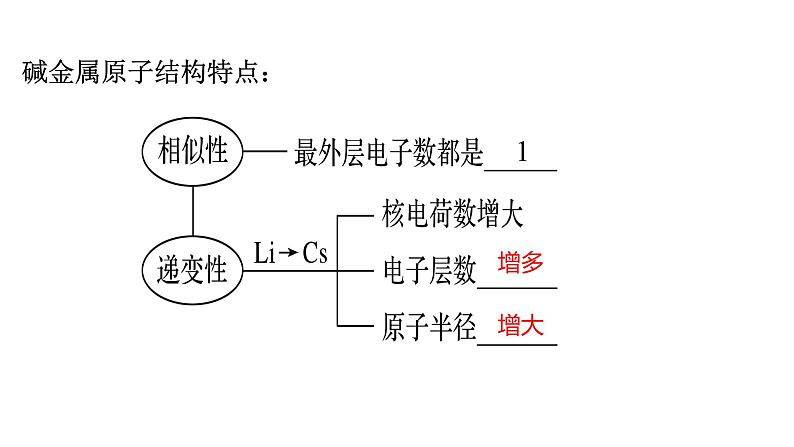
展开1.碱金属元素的原子结构规律
碱金属元素:ⅠA 族除氢以外的元素
一、碱金属元素的结构与性质的关系
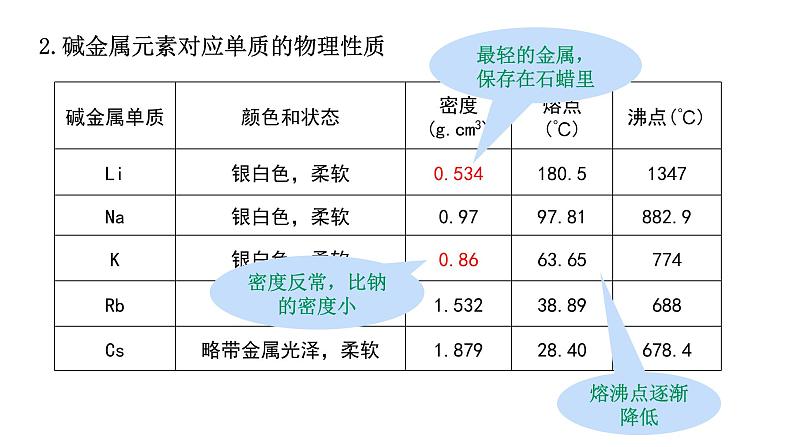
最轻的金属,保存在石蜡里
密度反常,比钠的密度小
2.碱金属元素对应单质的物理性质
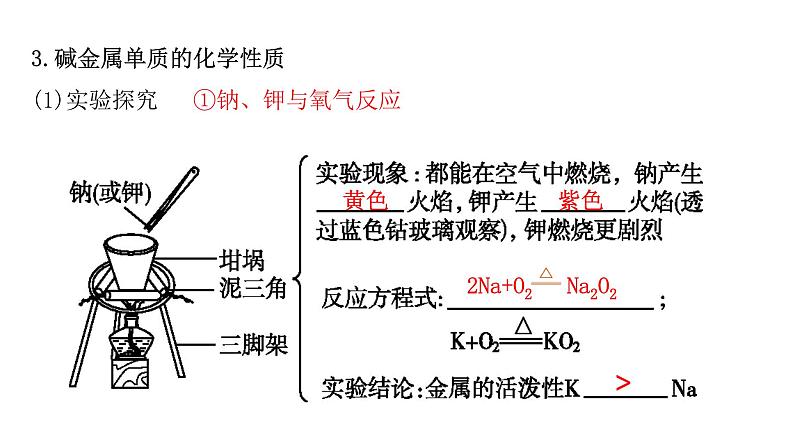
3.碱金属单质的化学性质(1)实验探究 ①钠、钾与氧气反应
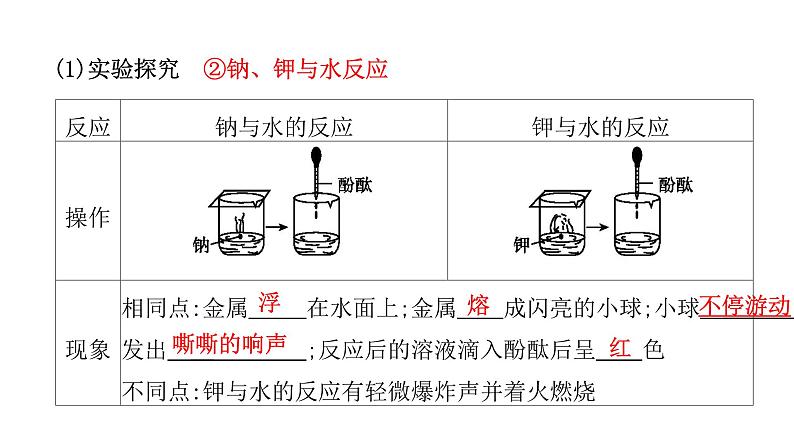
(1)实验探究 ②钠、钾与水反应
2Na+2H2O=2NaOH+H2↑
2K+2H2O=2KOH+H2↑
(2)碱金属的原子结构与化学性质的递变关系:从Li到Cs,随核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,元素金属性逐渐增强。
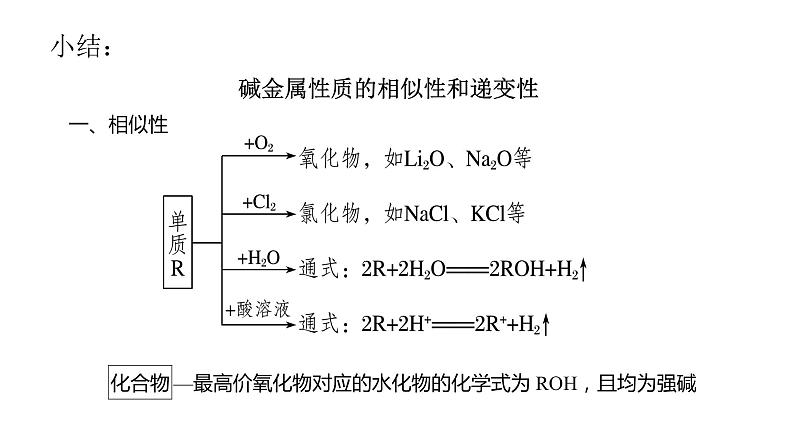
碱金属性质的相似性和递变性 一、相似性
二、碱金属元素性质的递变性具体情况如下:(1)与氧气反应从Li→Cs,与氧气反应越来越剧烈,产物越来越复杂。如Li与O2生成Li2O,Na与O2生成Na2O2,K与O2生成KO2。
(2)与H2O(或酸)的反应从Li→Cs,与H2O(或酸)反应越来越剧烈。如K与H2O反应能发生轻微爆炸,Rb、Cs则遇水发生爆炸。因Na、K等活泼的金属易与H2O反应,故不能从盐的水溶液中置换出不活泼的金属,只有在熔融状态下才能置换出不活泼的金属。(3)最高价氧化物对应的水化物的碱性: LiOH < NaOH < KOH < RbOH < CsOH。
总结:碱金属元素的递变规律
1.卤族元素的原子结构
二、卤族元素的结构与性质的关系
2.卤素单质的化学性质(1)卤素单质与氢气的化合
(2)卤素单质间的置换反应
2NaBr+Cl2===Br2+2NaCl
2KI+Cl2===2KCl+I2
Br2+2KI===2KBr+I2
卤素单质(X2)及其化合物的相似性和递变性
1.卤素单质的相似性和递变性(1)相似性
(2)递变性①单质的递变性
②卤素单质溶于水或有机溶剂呈现的颜色
3.特殊性(1)氟F无正价,非金属性最强,F-的还原性最弱。F2与H2在暗处即发生爆炸。F2是氧化性最强的非金属单质,与水反应生成O2:2F2+2H2O 4HF+O2。HF是弱酸,能腐蚀玻璃,保存在铅制器皿或塑料瓶中;有毒,在HX中沸点最高。
(4)卤化银①溶解性:AgCl、AgBr、AgI均不溶于水和稀硝酸,而AgF可溶于水。②颜色:AgF为白色,AgCl为白色,AgBr为淡黄色,AgI为黄色。③感光性:除AgF外,均有感光性,其中AgBr常作感光材料。
1.卤族元素单质化学性质的相似性和递变性(1)相似性(用X代表卤族元素):
化合物→最高价氧化物对应水化物(除氟外)都为强酸
具体表现如下:①与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,其水溶液的酸性逐渐增强,即:稳定性:HF>HCl>HBr>HI;还原性:HF
同族元素性质的递变规律
元素金属性强弱的判断(1)根据元素周期表判断同一主族从上到下,元素金属性逐渐增强。(2)根据金属活动性顺序判断K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 从左往右,金属单质的活动性逐渐减弱,元素的金属性一般也逐渐减弱。(3)根据单质及其化合物的性质判断①金属单质与水或酸反应越剧烈,元素的金属性越强。②最高价氧化物对应水化物的碱性越强,元素的金属性越强。(4)金属单质间的置换反应较活泼的金属能将较不活泼的金属从其盐溶液中置换出来,如Zn + Cu2+ ==Zn2+ + Cu,则金属性:Zn > Cu。(5)根据离子的氧化性强弱判断金属阳离子的氧化性越强,元素的金属性越弱。如氧化 :Cu2+ >Fe2+ ,则金属性:Cu
高中化学必修一 4.1.2 原子结构与元素的性质课件: 这是一份高中化学必修一 4.1.2 原子结构与元素的性质课件,共24页。
高中化学必修一 4.1.2 原子结构与元素的性质课件新: 这是一份高中化学必修一 4.1.2 原子结构与元素的性质课件新,共29页。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学演示课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学演示课件ppt,共54页。PPT课件主要包含了失去电子,金属性,得到电子,非金属性,最外层电子数均为1,NaOH+H2↑,KOH+H2↑,淡黄绿,深红棕等内容,欢迎下载使用。













