
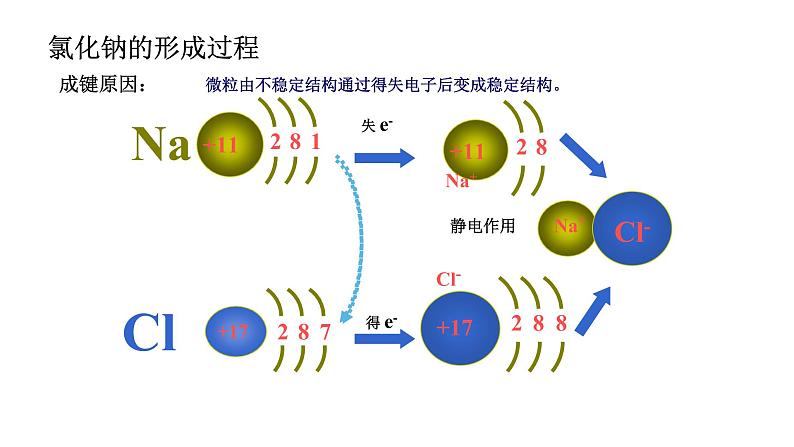





2021学年第三节 化学键图片ppt课件
展开微粒由不稳定结构通过得失电子后变成稳定结构。
静电作用(离子键的本质)
1、定义:带相反电荷离子之间的相互作用。
2、构成粒子:阴离子和阳离子
①活泼金属(IA、IIA)和活泼非金属 (VIA、VIIA)间
②金属阳离子(或NH4+ )和某些带电原子团之间
6、离子化合物含有离子键的化合物叫做离子化合物。
5、影响离子键强弱的因素离子半径和离子所带电荷,即离子半径越小、离子所带电荷越多,阴、阳离子间的作用就越强,离子键就越强。离子键越强物质的熔沸点就越高。
7、离子化合物的性质⑴具有较高的熔点和沸点,难挥发,常温下都是固体;⑵离子化合物固体不导电,熔化或溶于水后能导电。
8、常见的离子化合物①活泼金属氧化物:如Na2O、MgO②绝大多数盐:如CaCO3 、NH4Cl③强碱
9、离子化合物的三个“一定”和两个“不一定”(1)三个“一定”①离子化合物中一定含有离子键;②含有离子键的化合物一定是离子化合物;③离子化合物中一定含有阴离子和阳离子。(2)两个“不一定”①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;②含有金属元素的化合物不一定是离子化合物,如AlCl3。
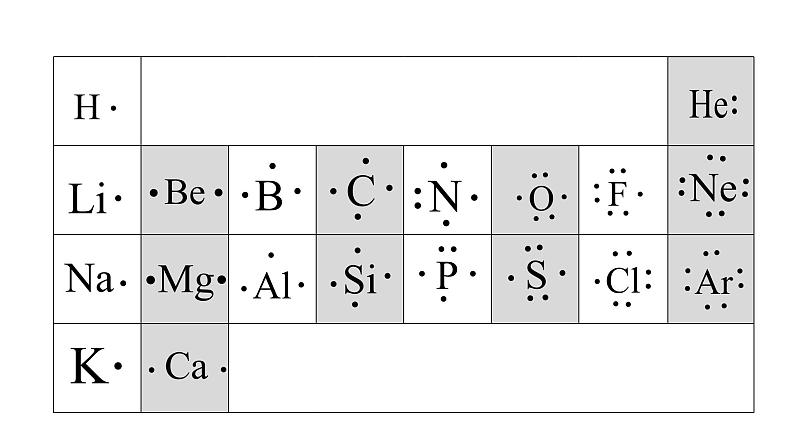
电子式:在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子。
二、用电子式法表示离子化合物
在元素符号周围(上下左右)用“ · ”或“×”来表示原子最外层电子
2、简单阳离子的电子式:
由于简单阳离子最外层电子已经失去,所以无最外层电子,即离子符号
3、简单阴离子的电子式:
练习:硫离子 氟离子 溴离子 氢负离子
由于阴离子的形成是由原子得电子形成,最外层电子数满足达到2e-或8e-结构,需将最外层电子数表示出来,并用中括号 “ [ ] ” 括上,并写出带电荷数
由阴、阳离子的电子式组成,但相同离子不能合并,尽量书写对称
4、离子化合物的电子式
练习:CaCl2、K2S
5、用电子式表示由原子形成离子化合物的过程
④右侧写离子化合物的电子式
②用弧形箭头表示电子转移的方向
和 原子形成HCl过程中,能否形成离子键?为什么?
HCl分子不是通过离子键来形成,是通过什么方式结合的呢?
不能,因非金属元素的原子均有获得电子的倾向。
我只有一个电子,太少了
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有,行吗?
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
原子之间通过共用电子对所形成的相互作用,叫做共价键。
3、成键作用力:“共用电子对”与两原子核的作用
4、成键元素:一般同种或不同种非金属元素之间(AlCl3也是共价键)
1、定义:原子间通过共用电子对所形成的相互作用
5、存在:非金属单质(稀有气体除外)、非金属氢化物、非金属氧化物、含氧酸、碱、部分盐(AlCl3、含氧酸盐)大多数有机物。
6、共价键强弱的影响因素原子半径和共用电子对数目,原子半径越小,共用电子对数目越多,一般共价键就越强。
1、定义:不同原子之间以共用电子对形成分子的化合物。
2、共价化合物的性质:①由原子构成的共价化合物熔点较高 如SiO2、SiC 。由分子构成的化合物熔点较低 如NH3 CO2 HCl ②共价化合物本身不导电,但是部分共价化合物的水溶液可以导电。
3、常见共价化合物的类型 ①酸:如 HCl、H2CO3 ②非金属氧化物:如 CO、NO 、CO2 ③非金属氢化物:如 NH3、H2S ④大多数有机化合物:如 C2H5OH、CH3COOH ⑤少数盐:AlCl3、 HgCl2
4、共价化合物中的“一定”与“不一定”(1)两个“一定”①共价化合物中一定只含有共价键;②共价化合物中一定不含离子键。(2)两个“不一定”①含共价键的物质不一定是共价化合物,也可能是单质,如O2;②含共价键的化合物不一定是共价化合物,也可能是离子化合物,如NaOH中含有O-H共价键,NH4Cl中含有N-H共价键,但它们都是离子化合物。
注意:①每个原子一般达到相对稳定结构②不加中括号[ ],不标正负电荷数③原子周围共用电子对数=8-原子最外层电子数
(2)结构式
分别用“-、═、≡”表示一对、二对和三对共用电子对
5、共价型分子及其形成的表示方法
(3)用电子式表示原子形成共价键
注意事项:1、共价型分子中没有电子得失,不能出现弧线箭头2、反应物写成原子的形式,反应物中相同原子可以合并。3、生成物中不能出现“[ ]”也不能标正负电荷,相同部分不能合并。
球棍模型可以形象的展示出分子的空间结构和成键情况
比例模型可以形象的看出分子中的各个原子的个数比和半径大小关系
(6)共价分子及其结构
6、离子化合物与共价化合物的判断方法
因此,在离子化合物中一定含有离子键,但也可能含有共价键,共价化合物中一定不存在离子键,肯定存在共价键。
1.定义:相邻的原子之间强烈的相互作用称为化学键
紧密相邻的两个或多个原子或离子间
化学键的形成与原子结构有关,主要通过两个途径来实现。
①原子的价电子间的转移 ——离子键
②原子的价电子间的共用——共价键
(1)稀有气体单质中不存在化学键(2)多原子单质分子中存在共价键。如:H2、O2、O3等(3)共价化合物分子中只存在共价键,不存在离子键。(4)离子化合物中一定存在离子键,可能存在共价键。如:Na2O2、NaOH、NH4Cl、Na2SO4等含有原子团的离子化合物(5)离子化合物可由非金属构成。如:NH4NO3、NH4Cl 等铵盐(6)非极性共价键可能存在于离子化合物中。如Na2O2
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程,所以化学反应中反应物一定有化学键被破坏
注意:化学反应中反应物的化学键不一定全部被破坏
如:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
只破坏反应物中的离子键,共价键未被破坏
3.物质发生变化时化学键的变化(1)化学反应过程 化学键一定包含化学键断裂和形成,但并不一定所有化学键都断裂。(2)离子化合物的溶解或熔化过程中化学键的变化 离子化合物溶解或熔化过程会断裂离子键。
(3)共价化合物的溶解或熔化过程中化学键的变化①溶解过程a.与水反应——共价键被破坏。如:CO2、SO2b.电解质溶于水——共价键被破坏。如:HCl、H2SO4、HNO3c.非电解质溶于水——共价键不被破坏,只破坏分子间作用力。如:乙醇、蔗糖等
②熔化过程a.由分子构成的共价化合物(分子晶体)——共价键不被破坏,只破坏分子间作用力。如:冰、干冰、蔗糖等多数共价化合物。b.由原子构成的共价化合物(原子晶体)——共价键被破坏。 如:SiO2晶体等少数共价化合物
(4)单质的溶解或熔化过程中化学键的变化①非金属单质a.与水反应——共价键被破坏,如:Cl2、F2等b.由分子构成的单质(分子晶体)—共价键不被破坏,只破坏分子间作用力。如:I2的升华、P4的熔化等c.由原子构成的单质(原子晶体)——共价键被破坏。如:金刚石、晶体硅的熔化等②金属单质金属键:金属晶体中,金属阳离子与自由电子之间的强烈的静电作用金属单质熔融——金属键被破坏
1.定义:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(2)强弱:比化学键弱
(3)主要影响物质的物理性质(熔沸点)
分子间的作用力强弱(范德华力)
结论:组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
练习2、下列物质变化时,需克服的作用力不属于化学键的是A 、HCl 溶于水 B 、 I2 升华 C 、 电解H2O D、 烧碱熔化
练习1、比较下列物质的沸点高低 HCl HBr HI
CH4 SiH4 GeH4 SnH4
NH3 PH3 AsH3 SbH3
H2O H2S H2Se H2Te
HF HCl HBr HI
NH3、H2O、HF的沸点偏高
(1)氢键是一种特殊的分子间作用力,不是化学键
(2)强弱:比化学键弱而比范德华力强
(3)氢键的表示方法:X—H···Y
X、Y可以相同,也可以不同,(主要F、O、N)。
高中化学人教版 (2019)必修 第一册第三节 化学键说课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键说课课件ppt,共18页。PPT课件主要包含了化学键,注意不包括分子,离子键,成键要素,阴阳离子,静电作用,②明显带离子的物质,2二个“不一定”,1三个“一定”,离子化合物等内容,欢迎下载使用。
2020-2021学年第四章 物质结构 元素周期律第三节 化学键课文配套课件ppt: 这是一份2020-2021学年第四章 物质结构 元素周期律第三节 化学键课文配套课件ppt,共30页。PPT课件主要包含了力的作用,NaCl,金刚石,化学键,注意①直接相邻,②强烈的相互作用,离子键,共价键,金属键,氯气和金属钠的反应等内容,欢迎下载使用。
高中人教版 (2019)第四章 物质结构 元素周期律第三节 化学键教课ppt课件: 这是一份高中人教版 (2019)第四章 物质结构 元素周期律第三节 化学键教课ppt课件,共34页。PPT课件主要包含了Cl-等内容,欢迎下载使用。













