

专题十 化学能与热能-2020年高三二轮复习化学学案
展开一对一学科教师辅导讲义
有志者,事竟成。
学生姓名: 年 级: 老 师:
上课日期: 上课时间: 课 次:
专题十 化学能与热能
【学习目标】:
重点、难点:
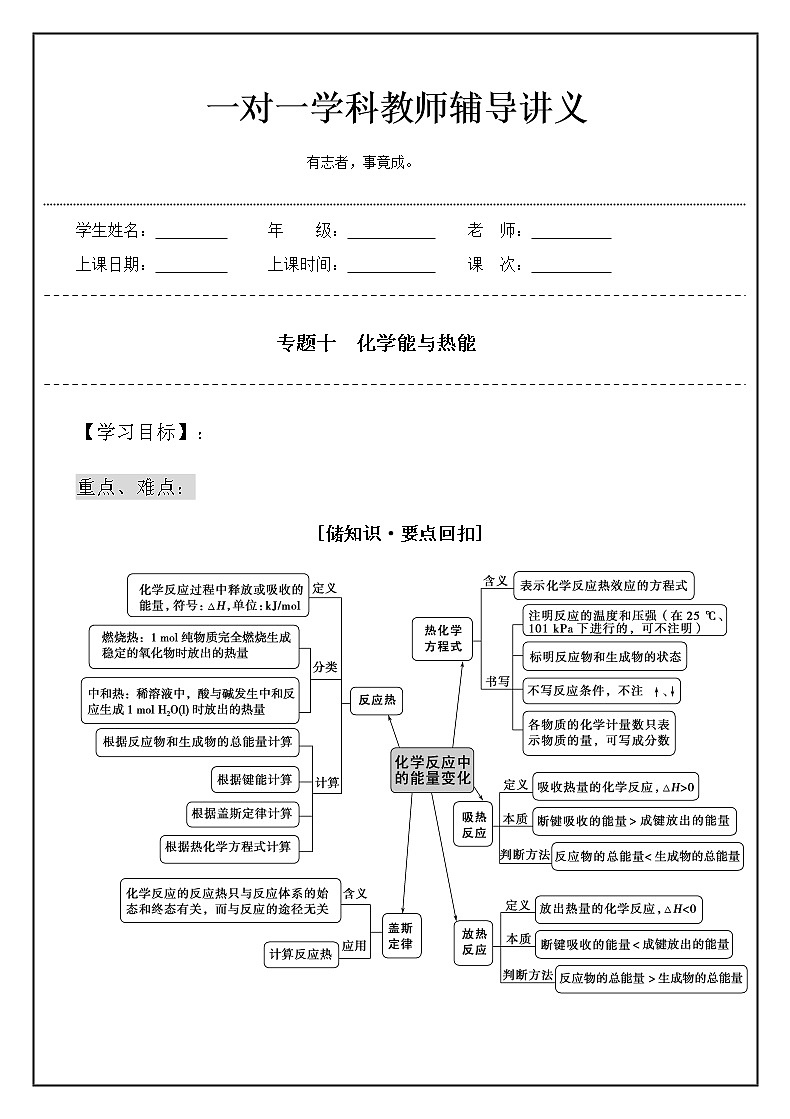
[储知识·要点回扣]
【学习内容】:
知识网络详解:
■思维深化——做一做
1.正误判断,正确的打“√”,错误的打“×”。
(1)
如图表示燃料燃烧反应的能量变化。( )
(2)在CO2中,Mg燃烧生成MgO和C。该反应中化学能全部转化为热能。( )
(3)催化剂能降低反应的活化能。( )
(4)同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同。( )
2.正确理解反应过程、能量图像
(1)E1:旧键断裂吸收的能量或称为正反应的____________。
(2)E2:新键形成放出的能量或称为逆反应的____________。
(3)ΔH=____________,为此反应的焓变。
(4)催化剂的作用:降低____________,但不影响________,反应放热还是吸热取决于________和________能量的高低。
3.2 mol H2SO4稀溶液和2 mol NaOH稀溶液混合,放出114.6 kJ热量。
(1)该反应的中和热ΔH=_______________________________,
(2)表示该反应的中和热的热化学方程式为______________。
(3)若用2 mol H2SO4浓溶液和2 mol NaOH浓溶液混合,放出的热量________114.6 kJ,原因是__________________。
4.在298 K、100 kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
(1)ΔH3与ΔH1、ΔH2的关系是_______________________。
(2)若H2O(l)===H2O(g) ΔH4,则氢气的燃烧热为______________________________________________________
[探高考·真题鉴赏]
1.(2019·高考全国卷Ⅱ)已知:(g)===(g)+H2(g) ΔH1=100.3 kJ·mol-1 ①
H2(g)+I2(g)===2HI(g) ΔH2=-11.0 kJ·mol-1 ②
对于反应:(g)+I2(g)===(g)+2HI(g) ③ ΔH3=________kJ·mol-1。
2.(2019·高考全国卷Ⅲ)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)===CuCl(s)+Cl2(g)
ΔH1=83 kJ·mol-1
CuCl(s)+O2(g)===CuO(s)+Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)===CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)的ΔH=________kJ·mol-1。
3.(2019·高考全国卷Ⅰ)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=________eV,写出该步骤的化学方程式_____________________________________
[研考纲·聚焦素养]
最新考纲
1.了解化学反应中能量转化的原因及常见的能量转化形式。
2.了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义,能正确书写热化学方程式。
4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
5.了解焓变(ΔH)与反应热的含义。
6.理解盖斯定律,并能用盖斯定律进行有关反应焓变的计算。
核心素养
1.变化观念与平衡思想:认识化学反应中的能量变化是由化学反应中旧化学键断裂和新化学键形成时的能量变化不同造成的,能从宏观和微观的不同角度分析化学反应中的能量变化,解决热化学的有关问题。
2.科学探究与创新意识:能发现和提出有探究价值的燃烧热、中和热测定等热化学问题,确定探究目的,设计探究方案,进行实验探究,并能根据实际情况改进实验装置,面对“异常”现象敢于提出自己的见解。
3.科学精神与社会责任:具有可持续发展意识和绿色化学观念,能合理利用常规能源,开发利用新能源和环保、清洁能源,能对与热化学有关的社会热点问题做出正确的价值判断。
题型一 热化学方程式的书写及反应热的计算
[研——题型探究]
1.(1)(2019·广东肇庆模拟节选)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为___________________________________________________________________________________________
(2)氨气具有还原性,例如,氨气能与卤素单质发生置换反应。已知几种化学键的键能数据如表所示:
化学键
N—H
N≡N
Br—Br
H—Br
键能/kJ·mol-1
391
946
194
366
请写出氨气与溴蒸气反应的热化学方程式:____________________________________________________________________。
(3)化学反应N2(g)+3H2(g)2NH3(l)的能量变化如图所示,该反应的热化学方程式是_________________________________。
(4)(2019·湖北沙市模拟)已知:25 ℃、101 kPa时,Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1
则SO2与MnO2反应生成无水MnSO4的热化学方程式是___________________________________________________________________________________________
(5)近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为______________________________________________________
_____________________________________________________。
[题型建模]
热化学方程式书写与正误判断易出现的5种常见错误
(1)“+”“-”漏写或使用不正确。即吸热反应未标“+”,放热反应未标“-”。
(2)单位与热量Q单位混淆。ΔH的单位为
“kJ·mol-1(或kJ/mol)”,易错写成“kJ”。
(3)物质的状态标注不正确。s、l、g和aq分别表示固态、液态、气态和水溶液。
(4)ΔH的数值不正确。即ΔH的数值必须与方程式中的化学计量数相对应。
(5)对概念的理解不正确。如燃烧热是指1 mol可燃物,且生成CO2(g)、H2O(l)、SO2 (g)等;中和热是指1 mol H+和1 mol OH-生成1 mol H2O(l)。
2.(1)(2019·山东泰安模拟)用NH3可除去烟气中氮的氧化物,主要反应如下:
①4NO(g)+4NH3(g)+O2(g)4N2(g)+6H2O(g) ΔH1=-1 627.2 kJ·mol-1
②6NO(g)+4NH3(g)5N2(g)+6H2O(g) ΔH2=-1 807 kJ·mol-1
③6NO2(g)+8NH3(g)7N2(g)+12H2O(g) ΔH3=-2 659.9 kJ·mol-1
则N2(g)+O2(g)===2NO(g) ΔH4=_______________kJ·mol-1。
已知:O2、NO中的化学键键能分别为497.3 kJ·mol-1、 631.65 kJ·mol-1,则N2中的化学键键能为________。
(2)①几种物质的能量(kJ·mol-1)如下表所示(在标准状态下,规定单质的能量为0,测得其他物质生成时放出的热量为其具有的能量):
物质
CO2(g)
H2(g)
CH2=== CH2(g)
H2O(g)
能量/ (kJ·mol-1)
-394
0
52
-242
计算2CO2(g)+6H2(g)===CH2=CH2(g)+4H2O(g)的ΔH,则ΔH=________kJ·mol-1。
②乙苯催化脱氢制苯乙烯反应:
已知:
化学键
C—H
C—C
C===C
H—H
键能/(kJ·mol-1)
412
348
612
436
计算上述反应的ΔH=________kJ·mol-1。
(3) 分别取100 mL 0.50 mol·L-1盐酸与100 mL 0.55 mol·L-1 NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5 ℃,反应后混合溶液的温度为24.9 ℃,则实验测得的中和热ΔH=________(保留1位小数)。
[练——即学即用]
1.甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g) ΔH1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键
H—H
C—O
H—O
C—H
E/(kJ·mol-1)
436
343
1 076
465
413
由此计算:(1)ΔH1=________kJ·mol-1;
(2)已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
2.(1)用NaOH溶液吸收热电企业产生的废气时,涉及如下转化:由下图关系可得:ΔH4=________。
(2)捕集处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料,已知:
①CO(g)+H2O(g)CO2(g)+H2(g),ΔH1=-41.0 kJ·mol-1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
③CH3OCH3(g)+H2O(g)2CH3OH(g) ΔH3=+23.5 kJ·mol-1
则反应2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)的ΔH=________。
(3)目前,对碳、氮及化合物的研究备受关注。已知:
Ⅰ.2C(s)+2NO(g)N2(g)+2CO(g) ΔH=-414.8 kJ·mol-1
Ⅱ.2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ·mol-1
Ⅲ.2CO(g)+2NO(g)N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1
表示碳的燃烧热的热化学方程式为_______________________
题型二 巧用题链 透析反应热、活化能及催化剂
[研——题型探究]
[题链1] 将CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ/mol。画出反应过程中体系的能量变化图(进行必要的标注)。
[题链2] CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)CaS(s)+4CO2(g) ΔH=-175.6 kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是________。
[题链3] 某实验室控制CO2和H2初始投料比为1∶2.2,在相同压强下,经过相同反应时间测得如下实验数据:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1 Ⅰ
O2(g)+H2(g)CO(g)+H2O(g) ΔH2 Ⅱ
T(K)
催化剂
CO2转化率(%)
甲醇选择性(%)
543
Cat.1
12.3
42.3
543
Cat.2
10.9
72.7
553
Cat.1
15.3
39.1
553
Cat.2
12.0
71.6
备注:Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比。
表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是:_______________。
[练——即学即用]
1.N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g)===CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程如图1所示,能量变化过程如图2所示,下列说法正确的是( )
A.由图1可知ΔH1=ΔH+ΔH2
B.加入Pt2O+,可使反应的焓变减小
C.为了实现转化需不断补充Pt2O+和Pt2O
D.由图2可知正反应的活化能小于逆反应的活化能
2.“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)===2H2O(l)+O2(g) ΔH=-196 kJ/mol,活化能Ea=76 kJ/mol,若用I-催化时,活化能Ea=57 kJ/mol。
(1)在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式:
反应甲:________________________________;
反应乙:_________________________________。
(2)反应甲为吸热反应,且甲的反应速率小于乙的反应速率。在下图中画出向H2O2溶液中加入KI后,反应过程的能量变化图。
[限时规范训练]
1.下列叙述正确的是( )
A.甲烷的燃烧热为ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g) +2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀硫酸溶液和稀Ba(OH)2溶液反应的反应热ΔH=2×(-57.3)kJ·mol-1
C.Mg在CO2中燃烧生成MgO和C,该反应中化学能全部转化为热能
D.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
解析:在燃烧热的热化学方程式中,H2O应为液态,A错误;稀硫酸和稀氢氧化钡溶液反应生成水,还生成硫酸钡,反应热ΔH<2×(-57.3)kJ·mol-1,B错误;Mg在CO2中燃烧发出耀眼的白光,化学能转化为热能和光能,C错误;C(s)+CO2(g)===2CO(g)是熵增反应但不能自发进行,说明ΔH>0,D正确。
答案:D
2.T<500 K时,反应NO2(g)+CO(g)===NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)―→NO3(g)+NO(g)(慢反应)
第二步:NO3(g)+CO(g)―→NO2(g)+CO2(g)(快反应)
下列叙述正确的是( )
A.反应速率与NO浓度有关
B.反应速率受NO2浓度影响较大
C.反应的中间产物为NO3和NO
D.第二步反应活化能较大
解析:NO是生成物,所以NO的浓度与该反应速率没有直接关系,A项错误;反应分两步进行,反应速率主要取决于“慢反应”,所以NO2的浓度对反应速率的影响较大,B项正确;由两步反应看出,反应物和最终产物中都没有NO3,所以反应的中间产物只有NO3,C项错误;因第二步反应是快反应,所以第二步反应的活化能较小,D项错误。
答案:B
3.NO与CO在金属铑(Rh)的催化下发生反应2NO(g)+CO(g)N2O(g)+CO2(g) ΔH,该反应过程经历如下两步:
反应Ⅰ:NO(g)+CO(g)+Rh(s)RhN(s)+CO2(g) ΔH1=-33.44 kJ·mol-1;
反应Ⅱ:RhN(s)+NO(g)Rh(s)+N2O ΔH2=-319. 35 kJ·mol-1。
如图所示为该反应在无催化剂(a)和有催化剂(b)时反应过程的能量变化对比图:
下列有关判断正确的是( )
A.ΔH=-285.91 kJ·mol-1
B.E1为反应2NO(g)+CO(g)N2O(g)+CO2(g)的活化能
C.E2为使用催化剂后降低的活化能
D.使用合适的催化剂可降低反应的活化能,提高反应速率
解析:应用盖斯定律,反应Ⅰ+反应Ⅱ可得反应2NO(g)+CO(g)N2O(g)+CO2(g) ΔH=ΔH1+ΔH2=-352.79 kJ·mol-1,A项错误;E1为2NO(g)+CO(g)N2O(g)+CO2(g)不使用催化剂和使用催化剂的活化能之差,B项错误;E2为2NO(g)+CO(g)N2O(g)+CO2(g)的焓变,C项错误;使用合适的催化剂可降低反应的活化能,从而提高反应速率,D项正确。
答案:D
4.某反应过程中体系的能量变化如图所示,下列说法错误的是( )
A.反应过程可表示为
―→―→
B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应ΔH=E1-E2<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应
解析:由图可知,正反应放热,ΔH为负值;逆反应吸热,ΔH为正值,D错误。
答案:D
5.反应A+B―→C分两步进行:①A+B―→X,②X―→C,反应过程中能量变化如图所示,E1表示反应A+B―→X的活化能。下列有关叙述正确的是( )
A.E2表示反应X―→C的活化能
B.X是反应A+B―→C的催化剂
C.反应A+B―→C的ΔH<0
D.加入催化剂可改变反应A+B―→C的焓变
解析:反应X―→C的活化能小于E2,A错误;由①②可知,X是反应A+B―→C的中间产物,B错误;反应物A和B的总能量大于生成物C的总能量,所以反应A+B―→C是放热反应,即ΔH<0,C正确;加入催化剂可以加快反应速率,但反应物和生成物具有的总能量不变,则反应的焓变不改变,D错误。
答案:C
6.一定条件下,在水溶液中1 mol Cl-、ClO(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是( )
A.e是ClO
B.b→a+c反应的活化能为60 kJ·mol-1
C.a、b、c、d、e中c最稳定
D.b→a+d反应的热化学方程式为3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=-116 kJ·mol-1
解析:A项,e中Cl化合价为+7价,而ClO中Cl的化合价为+5价,错误;B项,由图中数据无法确定反应b→a+c的活化能,错误;C项,a、b、c、d、e中a能量最低,所以a最稳定,错误;D项,b→a+d,根据转移电子守恒得该反应方程式为3ClO-===ClO+2Cl-,反应热=64 kJ·mol-1+2×0 kJ·mol-1-3×60 kJ·mol-1=-116 kJ·mol-1,所以该热化学方程式为3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=-116 kJ·mol-1,正确。
答案:D
7.当1,3丁二烯和溴单质1∶1加成时,其反应机理及能量变化如下:
不同反应条件下,经过相同时间测得生成物组成如下表:
实验编号
反应条件
反应时间
产物中A的物质的量分数
产物中B的物
质的量分数
1
-15 ℃
t min
62%
38%
2
25 ℃
t min
12%
88%
下列分析不合理的是( )
A.产物A、B互为同分异构体,由活性中间体生成A、B的反应互相竞争
B.相同条件下由活性中间体C生成产物A的速率更快
C.实验1测定产物组成时,体系已达平衡状态
D.实验1在t min时,若升高温度至25 ℃,部分产物A会经活性中间体C转化成产物B
解析:由1,3丁二烯和溴单质1∶1加成时的反应机理及能量变化示意图可知,该反应可以生成互为同分异构体的两种产物A和B,由活性中间体生成A、B的反应互相竞争,A项正确;由活性中间体生成A的活化能较低,故相同条件下由活性中间体C生成产物A的速率更快,B项正确;实验1测定产物组成时,无法判断体系是否达到平衡状态,C项错误;由图像可知,由活性中间体C生成A的反应为放热反应,若升高温度至25 ℃,平衡逆向移动,部分产物A会转化为活性中间体C,由表中数据可知,在较高的温度下,活性中间体C转化为B有竞争优势,故活性中间体更多的转化成产物B,D项正确。
答案:C
8.(1)工业上可用CO2和H2反应制得甲醇。在2×105Pa、300 ℃的条件下,CO2和H2反应生成甲醇和水,当消耗2 mol CO2时放出98 kJ的热量,该反应的热化学方程式为__________________________。
(2)辉铜矿(主要成分是Cu2S)在冶炼过程中会产生大量的SO2。已知冶炼过程中部分反应为
①2Cu2S(s)+3O2(g)===2Cu2O(s)+2SO2(g)
ΔH=-768.2 kJ·mol-1
②2Cu2O+Cu2S(s)===6Cu(s)+SO2(g) ΔH=+116 kJ·mol-1,则Cu2S与O2反应生成Cu与SO2的热化学方程式为_____________________________。
解析:(1)根据信息,该反应的热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1。
(2)根据盖斯定律,将①+②得,3Cu2S(s)+3O2(g)===6Cu(s)+3SO2(g) ΔH=(-768.2 kJ·mol-1)+(+116 kJ·mol-1)=-652.2 kJ·mol-1,即Cu2S(s)+O2(g)===2Cu(s)+SO2(g) ΔH=-217.4 kJ·mol-1。
答案:(1)CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1
(2)Cu2S(s)+O2(g)===2Cu(s)+SO2(g)
ΔH=-217.4 kJ·mol-1
9.能源问题日益成为制约国际社会经济发展的瓶颈。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)CH3OH(g)。如图表示反应中能量的变化。
请回答下列问题:
(1)在图中,曲线________(填“a”或“b”)表示使用了催化剂;该反应属于________(填“吸热”或“放热”)反应。
(2)科学家常用量热剂来直接测定某一反应的反应热,现测得:CH3OH(g)+O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1,又知H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,请写出32 g的CH3OH(g)完全燃烧生成液态水的热化学方程式
_____________________________________________________________________
_____________________________________________________________________
___________________________________________________________________。
解析:(1)加入催化剂,可降低反应的活化能,由图像可知b活化能较低,应加入催化剂;反应物的总能量大于生成物的总能量,所以该反应属于放热反应。
(2)①CH3OH(g)+O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1,
②H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,
利用盖斯定律将①-②×2可得CH3OH(g)+O2(g)===CO2(g)+2H2O(l) ΔH=-192.9 kJ·mol-1-44 kJ·mol-1×2=-280.9 kJ·mol-1。
答案:(1)b 放热
(2)CH3OH(g)+O2(g)===CO2(g)+2H2O(l) ΔH=-280.9 kJ·mol-1
10.(1)白磷与氧气可发生如下反应:P4+5O2===P4O10,已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1。
根据图示的分子结构和有关数据估算该反应的ΔH为______________________。
(2)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(s,白磷)+5O2(g)===P4O10(s)
ΔH1=-2 983.2 kJ·mol-1
②P(s,红磷)+O2(g)===P4O10(s)
ΔH2=-738.5 kJ·mol-1
则白磷转化为红磷的热化学方程式为_______________________________。
相同状况下,能量较低的是________;白磷的稳定性比红磷________(填“大”或“小”)。
解析:(1)化学反应的实质是旧键断裂和新键形成,其中旧化学键断裂吸收能量,新化学键形成释放能量,反应方程式P4+5O2===P4O10中有6 mol P—P键和5 mol O===O键断裂,同时生成4 mol P===O键和12 mol P—O键,因此ΔH=(6a+5d-4c-12b)kJ·mol-1。(2)依题意求:P4(s,白磷)===4P(s,红磷) ΔH=?,可设计如下反应过程:P4(s,白磷)→P4O10(s)→4P(s,红磷);并把反应②改写成:P4O10(s)===4P(s,红磷)+5O2(g) ΔH3=-4ΔH2,据盖斯定律有ΔH=ΔH1+(-4ΔH2)=(-2 983.2+4×738.5)kJ·mol-1=-29.2 kJ·mol-1,即P4(s,白磷)===4P(s,红磷) ΔH=-29.2 kJ·mol-1。白磷转化为红磷是放热反应,白磷稳定性比红磷小(能量越低越稳定)。
答案:(1)(6a+5d-4c-12b)kJ·mol-1
(2)P4(s,白磷)===4P(s,红磷)
ΔH=-29.2 kJ·mol-1 红磷 小
红磷________(填“大”或“小”)。
2023届高考化学二轮复习专题十化学实验基础与综合实验探究学案: 这是一份2023届高考化学二轮复习专题十化学实验基础与综合实验探究学案,共49页。
高考化学二轮复习专题6化学能与热能学案: 这是一份高考化学二轮复习专题6化学能与热能学案,共13页。
高三化学二轮复习-专题二 化学计量及其应用学案: 这是一份高三化学二轮复习-专题二 化学计量及其应用学案,文件包含专题二化学计量及其应用pptx、专题二化学计量及其应用docx等2份学案配套教学资源,其中学案共31页, 欢迎下载使用。












