






高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应本单元综合与测试教学ppt课件
展开The user can demnstrate n a prjectr r cmputer, r print the presentatin and make it int a film t be used in a wider field
吸热反应与放热反应的判断
(1)根据反应物和生成物的总能量大小判断反应物的总能量大于生成物的总能量的反应为放热反应,反之为吸热反应。(2)根据化学键断裂和形成时能量变化大小的关系推断破坏反应物中化学键吸收的能量大于形成生成物中化学键放出的能量的反应为吸热反应,反之为放热反应。
(3)根据经验规律判断用常见吸热和放热的反应类型来判断。(4)根据生成物和反应物的相对稳定性判断由稳定的物质生成不稳定的物质的反应为吸热反应,反之为放热反应。(5)根据反应条件判断需要持续加热才能进行的反应是吸热反应。反之,一般为放热反应。
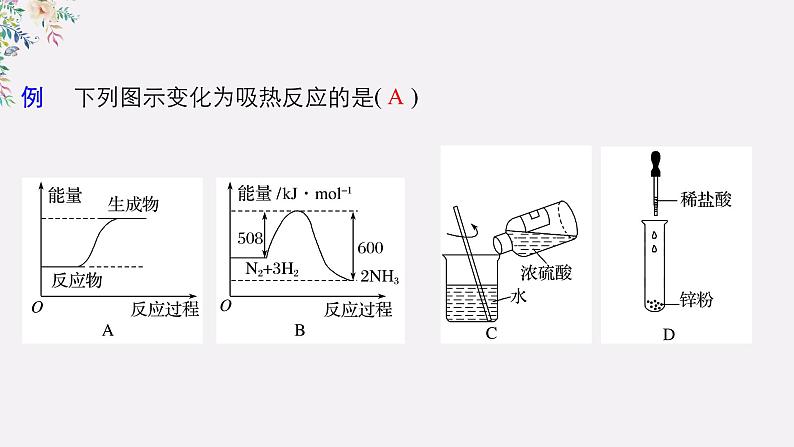
例 下列图示变化为吸热反应的是( )
1.反应热 在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热
等压条件下的反应热也可称为“焓变” 符号:∆H单位:kJ/ml规定:当∆H<0时,为放热反应;当∆H>0时,为吸热反应
热化学方程式的书写及正误判断
(1)必须在化学方程式的右边标明反应热ΔH的符号、数值和单位(ΔH与最后一种生成物之间留一空格):(2)ΔH与测定条件(温度、压强等)有关、因此应注明ΔH的测定条件。绝大多数ΔH是在25 ℃、101 kPa下测定的,此时可不注明温度和压强。
1.热化学方程式的书写
(3)反应热与物质的聚集状态有关,因此必须注明物质的聚集状态(s,l,g),溶液中的溶质标明“aq”。化学式相同的同素异形体除标明状态外还需标明其名称[如C(金刚石,s)]。热化学方程式中不标“↑”和“↓”,不写“点燃、△、高温、催化剂”等条件。(4)热化学方程式中的化学计量数只表示物质的量而不表示分子数或原子数。因此化学计量数可以是整数,也可以是分数。
2.热化学方程式的正误判断
(1)书写热化学方程式常见错误
漏写物质的聚集状态(漏一种就全错);ΔH的符号“+”、“-”标示错误;ΔH的值与各物质化学计量数不对应;ΔH后不带单位或单位写错(写成kJ、kJ·ml等)。
热化学方程式是否已配平,是否符合客观事实;各物质的聚集状态是否标明;反应热ΔH的数值与该热化学方程式的化学计量数是否对应;反应热ΔH的符号是否正确,放热反应的ΔH为“-”,吸热反应的ΔH为“+”。
(2)热化学方程式正误判断方法
例:燃烧1 g乙炔生成二氧化碳和液态水放出热量50 kJ,则下列热化学方程式书写正确的是( )A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=+50 kJ·ml-1B.C2H2(g)+ O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJC.2C2H2+5O2===4CO2+2H2O ΔH=-2 600 kJD.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·ml-1
1.盖斯定律的实质 不管化学反应是一步完成或是分几步完成,其反应热是相同的。即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。则有ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5。
2.盖斯定律的应用 根据盖斯定律,通过计算反应热,可以书写新的热化学方程式;比较反应热的大小,判断物质的稳定性(同素异形体稳定性比较)。运用盖斯定律分析解题的关键,设计出合理的反应过程,利用热化学方程式进行适当的加减等“运算”。
例:(1)(2018全国Ⅱ,27节选)CH4—CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·ml-1C(s)+O2(g)=CO2(g) ΔH=-394 kJ·ml-1
(2)(2018全国Ⅰ,28节选)已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=-4.4 kJ·ml-12NO2(g)=N2O4(g) ΔH2=-55.3 kJ·ml-1
该催化重整反应的ΔH= kJ·ml-1。
(3)(2018全国Ⅲ,28节选)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。SiHCl3在催化剂作用下发生反应:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·ml-13SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·ml-1则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH为 kJ·ml-1。 (4)(2018江苏卷,20节选)用水吸收NOx的相关热化学方程式如下:2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·ml-13HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9 kJ·ml-1反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH= kJ·ml-1。
在稀溶液中,酸跟碱发生中和反应生成1 ml水时的反应热。
H+(aq)+OH-(aq) == H2O(l)ΔH = -57.3 kJ•ml-1
(1)若弱酸与弱碱稀溶液反应,因为电离吸热, 故生成1mlH2O放热 < 57.3 kJ ,则ΔH > -57.3 kJ•ml-1(2)若强酸与强碱浓溶液反应,因为稀释放热, 故生成1mlH2O放热 >57.3 kJ,则ΔH < -57.3 kJ•ml-1 (3)若中和反应生成沉淀,因为形成沉淀放热,故生成1mlH2O放热 >57.3 kJ,则ΔH < -57.3 kJ•ml-1
101kPa时,1ml纯物质完全燃烧生成指定产物时所放出的热量
指定产物:碳元素变为CO2(g) 氢元素变为H2O(l) 硫元素变为SO2(g) 氮元素变为N2(g)
回答下列各问题:(1)上述反应中属于放热反应的是__________。(2)H2的燃烧热ΔH=______________ ; C的燃烧热ΔH=______________。(3)燃烧10 g H2生成液态水,放出的热量为_________。(4)CO的燃烧热ΔH=_________________,其燃烧热的热化学方程式为__________________________________________
-285.0 kJ·ml-1
-393.5 kJ·ml-1
-283.0 kJ·ml-1
1.由化学反应的本质(旧键断裂-新键生成)及化学反应能量变化的原因(反应物的总能量与生成物的总能量不等)可得: (1)反应热=断裂旧键所需的能量-生成新键释放的能量 (2)反应热=生成物的总能量-反应物的总能量 (3)反应热=反应物的总键能-生成物的总键能
△H =E(反应物断裂化学键吸收的能量)—E(形成化学键放出的能量)
△H= -cm△t/n
根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到新的热化学方程式,可进行反应热的有关计算。(1)热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。(2)热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。(3)将一个热化学方程式颠倒时,ΔH的“+”、“-”号必须随之改变。
①第一步反应是_______(填“放热”或“吸热”)反应,判断依据是___________________________________________。
ΔH<0(或反应物的总能量大于生成物的总能量)
(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
(1)比较“反应热”或ΔH的大小时,必须带“+”“-”符号;比较反应吸收或放出的热量的多少时,只需比较ΔH的绝对值的大小即可。(2)参加反应的物质的物质的量与反应热成正比(3)同一反应中物质的聚集状态不同,反应热数值大小也不同。 同种物质:E(g)>E(l)>E(s) g→l ΔH<0 ; l→sΔH<0 ; g→s ΔH<0
1.根据反应规律和影响ΔH大小的因素直接进行比较
2.根据反应进行的程度比较 对于可逆反应,如3H2(g)+N2(g) 2NH3(g) ΔH=-92.4 kJ·ml-1,是指生成2 ml NH3(g)时放出92.4 kJ的热量,而不是指3 ml H2和1 ml N2在一定条件下混合反应就可放出92.4 kJ的热量,实际上3 ml H2和1 ml N2在一定条件下混合反应放出的热量小于92.4 kJ,因为该反应的反应物不能完全转化为生成物。
(3)根据反应物的性质比较等物质的量的不同物质与同一种物质反应时,物质性质不同其反应热不同。如等物质的量的不同金属(或非金属)与同一种物质反应,金属(或非金属)越活泼反应越容易进行,放出的热量越多,对应的ΔH越小。例如Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g) ΔH1, Ca(s)+2HCl(aq)=CaCl2(aq)+H2(g) ΔH2, ΔH1>ΔH2。
例:比较下列各组热化学方程式中ΔH的大小(填“>”“<”或“=”)。
(2)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1_____ΔH2(填“>”、“<”或“=”)。
化学选择性必修1第二节 电解池教学课件ppt: 这是一份化学选择性必修1第二节 电解池教学课件ppt,文件包含421电解池-2020-2021学年高二化学选择性必修1同步教学课件新教材人教版pptx、实验4-2电解氯化铜溶液mp4、非常直观的水质检测方法_好看视频mp4等3份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
高中人教版 (2019)第三节 盐类的水解教学课件ppt: 这是一份高中人教版 (2019)第三节 盐类的水解教学课件ppt,共60页。PPT课件主要包含了知识回顾,科学探究,探究原因,水解方程式,1定义,2实质,是中和反应的逆反应,表达形式,想一想,盐类水解的特点等内容,欢迎下载使用。
2021学年第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH教学课件ppt: 这是一份2021学年第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH教学课件ppt,共24页。PPT课件主要包含了1温度,酸性条件不能共存,碱性条件不能共存,能共存,1×10-7,溶液的pH,1定义,cH+的负对数,2使用范围,酸性溶液等内容,欢迎下载使用。













