


所属成套资源:学年高二化学选择性必修1同步教学课件(新教材人教版)
高中人教版 (2019)第三节 盐类的水解教学课件ppt
展开
这是一份高中人教版 (2019)第三节 盐类的水解教学课件ppt,共60页。PPT课件主要包含了知识回顾,科学探究,探究原因,水解方程式,1定义,2实质,是中和反应的逆反应,表达形式,想一想,盐类水解的特点等内容,欢迎下载使用。
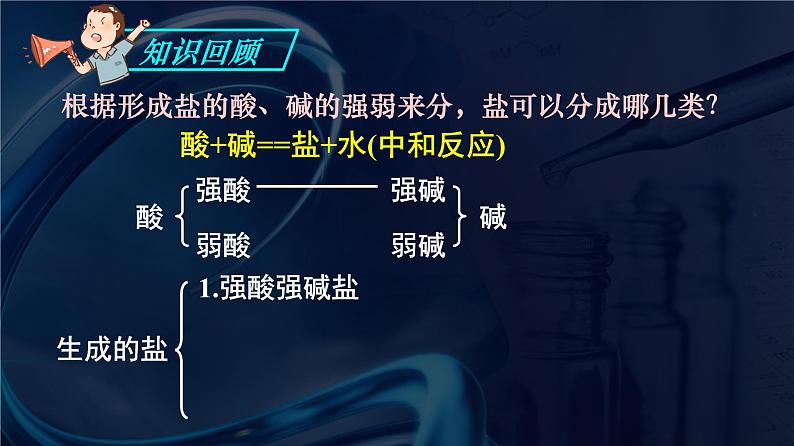
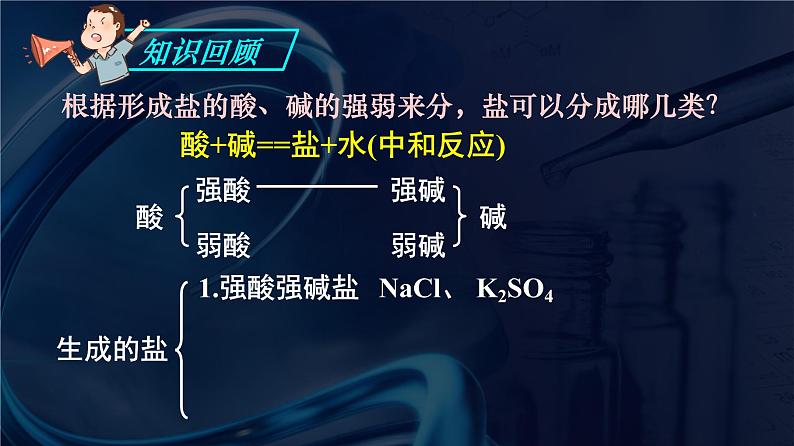
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸+碱==盐+水(中和反应)
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONa、K2CO3
CH3COONH4、(NH4)2CO3
科学探究:1盐溶液的酸碱性
科学探究:1盐溶液的酸碱性
2.盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
当分别加入 NaCl、NH4Cl、CH3COONa 形成溶液后,请思考:
(1) 相关的电离方程式?(2) 盐溶液中存在哪些粒子?(3) 哪些粒子间可能结合(生成弱电解质)?(4) 对水的电离平衡有何影响?(5) 相关的化学方程式?
分析后,填写书 P70 表格
【探究1】 往水中加NaCl形成溶液。
H2O H+ + OH–
NaCl Cl– + Na+
Na+、Cl–、H+、OH–、H2O
c(H+) c(OH–)
(对水的电离平衡无影响)
【探究2】 往水中加NH4Cl形成溶液。
H2O H+ + OH–
NH4Cl Cl– + NH4+
NH3 · H2O
Cl–、NH4+、H+、OH–、
H2O、NH3 · H2O
NH4Cl + H2O NH3 · H2O + HCl
NH4+ + H2O NH3 · H2O + H+
【探究3】往水中加CH3COONa形成溶液。
CH3COONa= Na+ + CH3COO–
H2O OH– + H+
Na+、 CH3COO–、 OH–、 H+、H2O、CH3COOH
CH3COONa + H2O CH3COOH + NaOH
CH3COO– + H2O CH3COOH + OH–
在溶液中盐电离出来的离子跟水所电离出来的 H+或 OH- 结合生成弱电解质的反应,叫做盐类的水解。
3.盐类的水解定义及实质
弱酸根阴离子或弱碱阳离子
——盐溶液呈不同酸碱性的原因
3.盐类的水解的定义及实质
在溶液中盐电离出来的弱酸根阴离子或弱碱阳离子与水电离出来的H+或OH -结合生成弱电解质,从而促进了水的电离平衡,增大了水的电离度。
盐+水 酸+碱
例1:常温下,pH=5 的盐酸中,与 pH=5 的NH4Cl 溶液中,两种溶液中水的电离程度之比为?
酸、碱抑制水的电离;水解的盐促进水的电离
水解反应能一直进行下去吗?
CH3COONa == CH3COO_ + Na+
H2O H+ + OH_
当 CH3COOH 与 OH- 浓度逐渐增大,到一定程度则 发生酸碱中和反应, 即向左反应,故盐类水解不能彻底进 行,最后到达一个平衡状态,即水解平衡 。
盐类水解是一个微弱的过程!
可逆、微弱、吸热,存在水解平衡状态
5、盐类水解规律
有弱才水解,无弱不水解;都弱都水解,越弱越水解;谁强显谁性,同强显中性。
2.常温下,下列溶液 pH小于7的是
A. KBr B. CuSO4 C. NaF D. Ba(NO3)2
3.下列溶液显碱性的是
A. K2CO3 B. NaHSO4 C. Na2S D. FeCl3
1.下列离子在水溶液中不会发生水解的是
A. NH4+ B. SO42_ C. Al3+ D. F_
6. 盐类水解方程式的书写规律
①盐类水解(单一离子水解)一般是比较微弱的,通常用“ ”表示,水解生成的难溶物及气体,一般不标“↓”或“↑”
②多元弱酸的酸根离子水解是分步进行的,第一步水解程度比第二步水解程度大得多(与电离类似),以第一步为主,绝对不能两步合并写。
③多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。(与多元弱碱的电离类似)
④弱酸弱碱盐发生双水解(完全水解)
例:Al3+ 和 HCO3- 在溶液中完全水解
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
两离子产生的 H+、OH-相反应生成水,促使两水解平衡均向右移动。当 H2CO3 浓度增大到一定程度时便放出 CO2,同时析出 Al(OH)3 沉淀,最终促使 HCO3-、Al3+ 均完全水解。
②Al3+与CO32-、HCO3- 、SO32-、HSO3-、 S2-、HS- 、AlO2-、SiO32-、ClO-
③NH4+ 与 SiO32-、 AlO2-等。
弱酸弱碱盐发生完全水解,相互促进,通常用“ = ”
表示,水解生成的难溶物及气体,标“↓”或“↑”
①Fe3+与CO32-、HCO3-、ClO-、SiO32-、AlO2-
注:NH4+ 与 CH3COO-、 HCO3-、 S2-、CO32-虽然发生相互促进,但水解程度较小,能大量共存。
写出 AlCl3 与 Na2S 溶液混合 的水解离子方程式
例:书写下列物质水解的方程式:Al2S3、Mg3N2
Al2S3+3H2O = 2Al(OH)3 ↓ +3H2S ↑Mg3N2+6H2O = 3Mg(OH)2 ↓ +2NH3 ↑
Al2S3+3H2O = 2Al(OH)3 ↓ +3H2S ↑Mg3N2+6H2O = 3Mg(OH)2 ↓ +2NH3 ↑“双水解”若有沉淀和气体生成,脱离反应体系则用“=”连接,且用“↓”、“↑”符号。但并不是所有的弱酸弱碱盐水解都能进行“完全双水解”.
如:(NH4)2CO3 、NH4HCO3、 CH3COONH4
NaHCO3 溶液显什么性?为什么?
弱酸的酸式盐溶液的酸碱性:要看酸式酸根电离和水解的相对强弱。
小结:酸式盐 (NaHA) 的酸碱性
①强酸的酸式盐只有电离而无水解,则呈酸性(如NaHSO4)
①强酸的酸式盐只有电离而无水解,则呈酸性(如NaHSO4)②弱酸的酸式盐既有电离又有水解,取决于两者相对大小
电离:HA- ⇌ H+ + A2- (显酸性)水解:HA- + H2O ⇌ H2A + OH- (显碱性)
相关课件
这是一份化学人教版 (2019)第三节 盐类的水解集体备课ppt课件,共24页。PPT课件主要包含了复习导入,生成的盐,强酸强碱盐,强酸弱碱盐,强碱弱酸盐,弱酸弱碱盐,生成NH3·H2O,促进水的电离,总反应,离子方程式等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第三单元 盐类的水解一等奖ppt课件,共29页。PPT课件主要包含了核心素养发展目标,学习目标,课前导入,盐溶液的酸碱性,NH4Cl,习题研究,课堂总结等内容,欢迎下载使用。
这是一份高中化学第三节 盐类的水解获奖课件ppt,共29页。PPT课件主要包含了考纲要求,盐溶液的酸碱性,实验探究,实验结论,NH3·H2O,CH3COOH,盐类的水解,弱电解质等内容,欢迎下载使用。










