










高中化学鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律本章综合与测试完美版课件ppt
展开鲁科版必修第二册
第二章 化学键 化学反应规律复习总结
化学反应
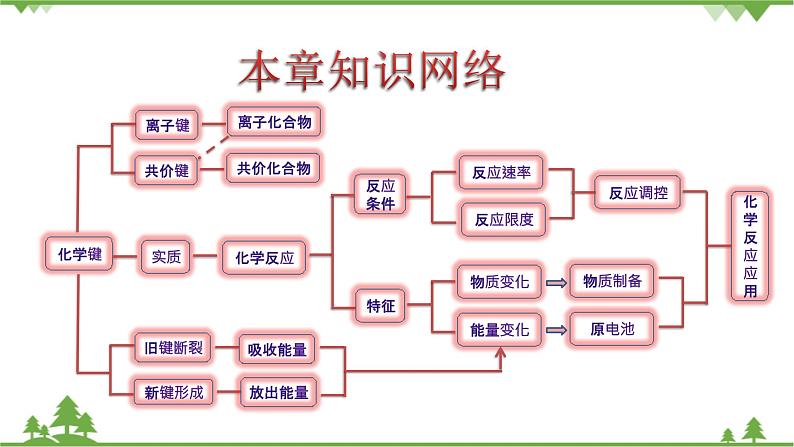
本章知识网络
【典型例题1】化学键是相邻原子之间强烈的相互作用。下列有关化学键的说法正确的是 ( ) A.KOH中既含有离子键也含有共价键,属于离子化合物 B.N2属于单质,不存在化学键 C.MgCl2中既含有离子键,又含有共价键 D.NH4Cl中含有共价键,又全部由非金属元素组成,属于共价化合物
知识点一:离子键、共价键、离子化合物、共价化合物
【解析】选A。N2中存在共价键;MgCl2中只含有离子键;NH4Cl中虽然含有共价键,又全部由非金属元素组成,但也含有离子键,属于离子化合物。
A
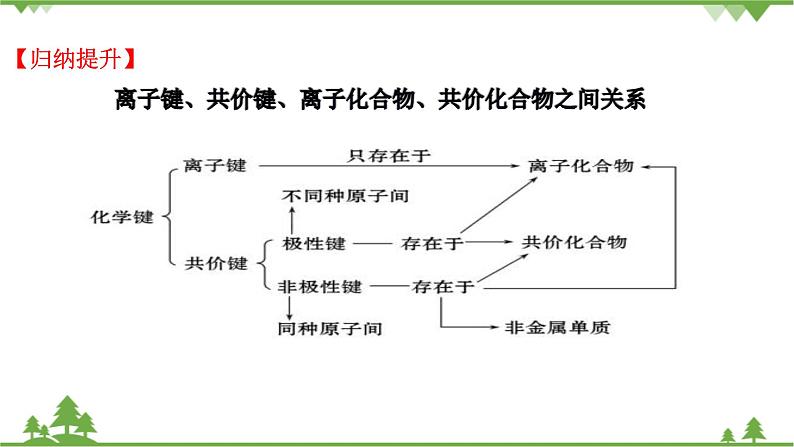
【归纳提升】
离子键、共价键、离子化合物、共价化合物之间关系
知识点二:离子键、共价键形成过程的电子式表示
【典型例题2】下列用电子式表示化合物的形成过程中,正确的是( )
B
(1)电子式表示化合物形成过程时,箭头左端为原子电子式,右端为化合物的电子式。(2)离子键形成存在电子转移,应用 标出电子转移方向。(3)书写离子化合物与共价化合物电子式时的差别:是否有[ ]、正负电荷。(4)左端相同的原子电子式可以合并,右端相同的离子或原子不能合并。(5)未成键的孤对电子不能省略。
【归纳提升】
知识点三:放热反应与吸热反应
【典型例题3】下列说法正确的是 ( )A.Fe与S在加热条件下才能发生反应,所以该反应属于吸热反应B.HNO3、H2SO4分别与NaOH溶液反应都放出热量C.分解反应都是吸热反应,化合反应都是放热反应D.合成氨的反应是放热反应,所以N2与其他物质的反应也是放热反应
【解析】选B。Fe与S虽然需加热才能发生反应,但反应开始后,停止加热,反应能继续进行,加热只是为了引发反应,所以该反应是放热反应,A错误;中和反应都是放热反应,B正确;分解反应不一定是吸热反应,如H2O2的分解反应就是放热反应,化合反应也不一定是放热反应,如CO2与C的反应就是吸热反应,C错误;与N2反应的物质不同,能量变化也不同,不能根据合成氨反应的能量变化来类推N2与其他物质反应的能量变化,如N2和O2在放电条件下生成NO就是吸热反应,D错误。
B
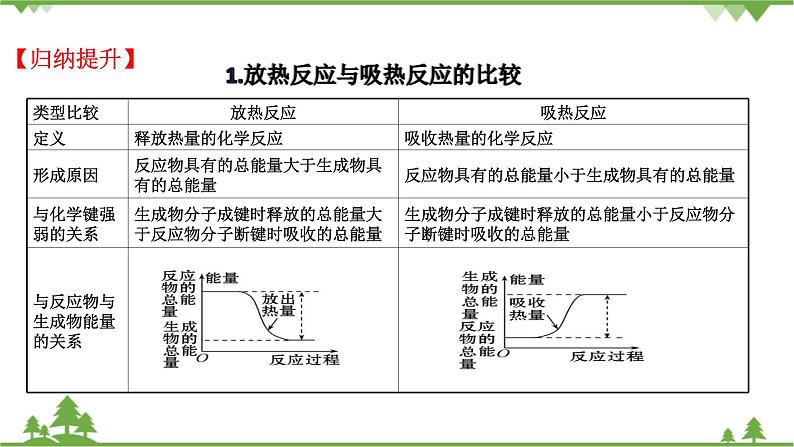
【归纳提升】
1.放热反应与吸热反应的比较
知识点四:利用化学键计算化学反应中的能量变化
【典型例题4】下表中的数据表示破坏1 mol化学键需消耗的能量,根据表中数据计算以下反应生成1 mol CO2时的热量变化 ( ) CH4(g)+2O2(g) CO2(g)+2H2O(g)
A.放出热量800 kJ B.放出热量1 520 kJC.吸收热量110 kJ D.放出热量610 kJ
A
【解析】选A。1个CH4中含4个C—H键,1个O2中含1个O=O键,1个CO2中含2个C=O键,1个H2O中含2个H—O键。生成1 mol CO2时,断裂4 mol C—H键和2 mol O=O键,吸收的热量为Q吸=4×415kJ+2×498 kJ=2 656 kJ。形成4 mol H—O键和2 mol C=O键,释放的热量为Q放=4×465 kJ+2×798 kJ=3 456 kJ,因为Q放>Q吸,所以反应放热。放出的热量为ΔQ=Q放-Q吸=3456 kJ-2656 kJ=800 kJ。
【归纳提升】
1.化学键与能量变化的关系:
2.计算公式:
公式:ΔQ=Q(吸)-Q(放) ΔQ大于0为吸热反应 ΔQ小于0为放热反应
用Q(吸)表示反应物分子化学键断裂时吸收的总能量,Q(放)表示生成物分子化学键形成时放出的总能量。
【典型例题5】一种新型的电池,总反应:3Zn+2 +8H2O=2Fe(OH)3↓+3Zn(OH)2↓+4OH-,其工作原理如图所示。下列说法不正确的是 ( )
知识点五:原电池的构成条件及正负极的判断方法
A.Zn极是负极,发生氧化反应B.随着反应的进行,溶液的pH增大C.电子由Zn极流出到石墨电极,再经过溶液回到Zn极,形成回路D.溶液中的K+移向石墨电极
C
【解析】选C。根据电池总反应,Zn的化合价升高,根据原电池的工作原理,即锌作负极,发生氧化反应,故A说法正确;根据电池总反应方程式,生成OH-,溶液的pH增大,故B说法正确;根据原电池的工作原理,电子从Zn电极流出经外电路流向石墨,电解质溶液应是阴阳离子定向移动,没有电子通过,故C说法错误;溶液中阳离子移向正极,故D正确。
【归纳提升】
原电池正负极的判断方法
【典型例题6】过量铁与少量稀硫酸反应,为了加快反应速率,但是又不影响生成氢气的总量,可以采取的措施是 ( )A.加入适量NaCl溶液 B.加入适量的水C.加入几滴硫酸铜溶液 D.再加入少量稀硫酸
知识点六:原电池原理的应用
【解析】选C。若加入NaCl溶液或水,会将稀硫酸稀释,c(H+)减小,反应速率减慢;若加入几滴CuSO4溶液,则发生反应Fe+Cu2+=Cu+Fe2+,析出的Cu与Fe、稀硫酸形成原电池,反应速率加快且不影响生成H2的总量;若再加入少量稀硫酸,因Fe过量,则生成H2的总量增大,且反应速率不会改变。
C
【归纳提升】
原电池原理的应用
1.加快化学反应速率一个自发进行的氧化还原反应,设计成原电池可以加快反应速率。
2.比较金属活泼性强弱: 两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
3.设计原电池(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂为电解质溶液中的阳离子(或在正极上被还原)。
【典型例题7】在1 L的密闭容器中,发生反应4A(s)+3B(g) 2C(g)+D(g),经2 min后B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是 ( )
知识点七:化学反应速率计算和比较
A.用A表示的反应速率是0.4 mol·L-1·min-1B.用B、C、D分别表示反应的速率,其比值是3∶2∶1C.在第2 min末的反应速率用B表示是0.3 mol·L-1·min-1D.在这2 min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大
B
【解析】选B。A为固体,一般不用固体表示反应速率,A项错误;同一反应中,用不同物质表示的速率与方程式中各物质的化学计量数成正比,B项正确;反应速率为平均值,并非2 min末的速率,C项错误;同一时间段内,用反应物、生成物表示的速率的意义是相同的,变化趋势也是一样的,D项错误。
【归纳提升】
化学反应速率计算和比较方法
1.化学反应速率的计算(1)定义式法:v(A)=
(2)关系式法:对于化学反应:aA(g)+bB(g)=cC(g)+dD(g),满足如下关系: v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶d。上述关系可总结为化学反应速率数值之比=化学计量数之比。
2.化学反应速率的大小比较——归一法①统一单位:若单位不统一,则要换算成相同的单位;②换算:若为不同物质表示的反应速率,则要换算成同一物质来表示反应速率;③比较:比较数值的大小,数值越大,反应速率越快。
【典型例题8】一定条件下,分别对反应C(s)+CO2(g) 2CO(g)进行如下操作(只改变条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是 ( ) A.①②③④ B.①③④ C.①② D.①③
知识点八:外界条件对化学反应速率的影响
【解析】选D。①升高反应体系的温度,反应速率显著增大,正确;②C为固体,增加反应物C的用量,反应速率不变,错误;③缩小反应体系的体积,CO2、CO的浓度增大,反应速率增大,正确;④减少体系中生成物CO的量,反应速率不可能增大,错误,选D。
D
【归纳提升】
1.浓度(1)只适用于气体参加或在溶液中进行的化学反应。(2)在一定温度下,固体或纯液态物质的浓度是一个常数,改变其用量,对化学反应速率无影响。
2.温度(1)对任何化学反应都适用,且不受反应物状态的影响。(2)不论是吸热反应还是放热反应,升高温度都能增大化学反应速率,降低温度都能减小化学反应速率。
3.压强(1)压强对化学反应速率的影响实质是通过改变浓度对化学反应速率的影响实现的。(2)由于固体或液体的体积受压强的影响很小,所以压强只影响有气体参加的化学反应的反应速率。(3)改变压强必须引起反应物或生成物的浓度改变才能改变化学反应速率,否则,化学反应速率不变。如恒温恒容:充入稀有气体→容器压强增大,各反应物的浓度不变→化学反应速率不变。
4.催化剂催化剂能同等程度地改变正、逆反应的化学反应速率。5.固体接触面积化学反应速率与固体颗粒的大小有关,颗粒越小,表面积越大,化学反应速率越快。
外界条件对化学反应速率的影响
【典型例题9】一定条件下,可逆反应N2+3H2 2NH3达到化学平衡状态,下列说法一定正确的是 ( )A.每1 mol N≡N断裂的同时有2 mol N—H生成B.N2、H2、NH3的浓度之比为1∶3∶2C.N2减少的速率和NH3减少的速率之比为1∶2D.气体体积为初始体积的二分之一
知识点九:化学平衡状态的判定
C
【解析】选C。反应速率之比是相应的物质化学计量数之比,根据方程式可知,每1 mol N≡N断裂的同时有6 mol N—H生成,A不正确;平衡时物质的浓度不再发生变化,但各物质的浓度之间不一定相等或满足某种关系,B不正确;达到平衡状态时正逆反应速率相等,则N2减少的速率和NH3减少的速率之比为1∶2,C正确;不知道转化率,则不能确定气体体积和初始体积的关系,D不正确。
1.直接标志(1)v(正)=v(逆)①同一种物质的生成速率等于消耗速率②在化学方程式同一边的不同物质的生成速率与消耗速率之比等于化学计量数之比③在化学方程式两边的不同物质的生成(或消耗)速率之比等于化学计量数之比(2)各组分的浓度保持一定①各组分的浓度不随时间的改变而改变②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变
【归纳提升】
判断化学平衡状态的两个标志
2.间接标志(1)恒温恒容反应体系中的总压强不随时间的改变而变化(适用于反应前后气体体积不等的反应)。(2)恒温恒压条件下,混合气体的密度不随时间的改变而变化(适用于反应前后气体体积不等且无固体、液体参与或生成的反应)。(3)对于反应混合物中存在有颜色变化的物质的可逆反应,若体系中颜色不再改变,则反应达到平衡状态。(4)全是气体参加的反应前后化学计量数改变的可逆反应,平均相对分子质量保持不变。(5)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
【归纳提升】
高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课前预习ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课前预习ppt课件,共21页。PPT课件主要包含了交流与思考,牛刀小试,思考与交流,离子大量共存等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课文内容ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课文内容ppt课件,共10页。PPT课件主要包含了物质的分类,胶体的性质,电解质和非电解质,离子方程式的意义,氧化还原反应等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序课文内容课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序课文内容课件ppt,共42页。PPT课件主要包含了交流与思考,铁盐性质,知识回顾,牛刀小试,硫及其化合物,思考与交流,二氧化硫,浓硫酸,环境问题,氮循环氮固定等内容,欢迎下载使用。













