





高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序课文内容课件ppt
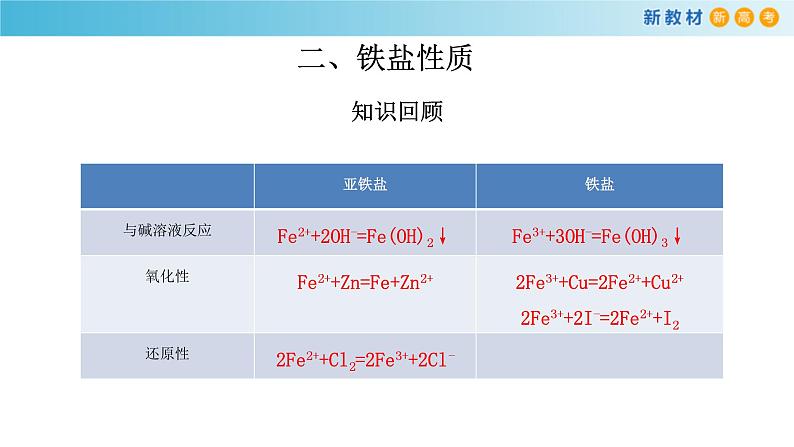
展开一、铁的存在 知识回顾1.铁元素在自然界以游离态(如陨铁)或化合态(如氧化铁)存在。2.我们日常生活中含有铁元素的物质:铁勺子、激光打印机的墨粉、补铁酱油、铁架等。3.亚铁盐:组成中含有Fe2+的盐,如FeSO4、FeCl2、Fe(NO3)2等。4.铁盐:组成中含有 Fe3+ 的盐,如 Fe2(SO4)3、FeCl3、Fe(NO3)3等
1.含有铁元素的物质在人类的生活和生产中有着重要的作用,你能列举出一些用途吗?2.铁单质的化学性质有哪些?与酸反应的化学方程式:与氧气反应化学方程式:与氯气、硫反应化学方程式:与盐溶液反应化学方程式:
牛刀小试1.铁和硫酸铜反应现象及化学方程式是什么?2.从不同角度将下列物质分类 硫酸铁、氯化亚铁、硫酸亚铁、氯化铁、硝酸铁、硝酸亚铁、硫化亚铁、硫化铁
交流与思考1.从物质类别的角度看,亚铁盐和铁盐属于盐类,根据初中知识“盐的化学性质”你能预测亚铁盐和铁盐的化学性质吗?金属单质分别和亚铁盐、铁盐反应,你如何设计实验?碱溶液和亚铁盐、铁盐反应,你如何设计实验?······2.从化合价角度看,铁盐中铁元素的化合价是多少?具有氧化性还是还原性?如何设计实验证明呢?亚铁盐中铁元素的化合价是多少?具有氧化性还是还原性?如何设计实验证明呢?3.向盛有氯化铁溶液的试管中滴加氢氧化钾溶液,观察实验现象并从离子角度分析反应实质。4.向盛有氯化铁溶液的试管中滴加氢氧化钾溶液,观察实验现象。5.向盛有硫酸亚铁溶液的试管中滴加氢氧化钾溶液,观察实验现象。6.向盛有硫酸亚铁溶液的试管中滴加氢氧化钾溶液,观察实验现象。7.向盛有硫酸亚铁溶液中加入锌粒,观察实验现象。
1.下列有关铁及其化合物的说法正确的是( )A.铁的氧化物有FeO、Fe2O3、Fe3O4,它们都是黑色的固体B.铁的氢氧化物Fe(OH)2、Fe(OH)3的混合物可能是灰绿色C.鉴别Fe2+中混有Fe3+,可先加入Cl2水,再加入KSCN溶液D.铁的合金生铁比纯铁硬度大,熔点高。2.某500mL溶液中含0.1ml Fe2+,0.2ml Fe3+,加入0.2ml铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)A.0.4ml/LB.0.6ml/LC.0.8 ml/LD.1.0 ml/L
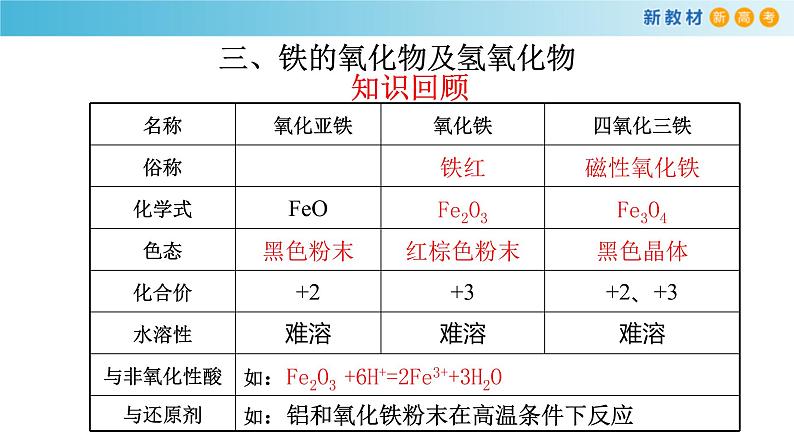
三、铁的氧化物及氢氧化物
1铁的氧化物、氢氧化物分别有哪些?每种化合物物中铁元素的化合价是多少?2.从物质类别角度考虑,铁的氧化物及氢氧化物有那些性质?3.从化合价别角度考虑,铁的氧化物及氢氧化物有那些性质?
1.关于铁的三种氧化物(FeO、Fe2O3、Fe3O4)的下列叙述中正确的是( )A.铁的三种氧化物中铁元素的化合价完全相同B.都是碱性氧化物,都能与盐酸反应生成氯化铁和水C.氧化亚铁在空气中加热可生成更稳定的四氧化三铁D.四氧化三铁中铁元素有+2价和+3价,它是一种混合物2.氧化铁和氧化亚铁都能与氢碘酸反应,下列相关叙述中正确的是( )A.都有铁盐生成 B.都有亚铁盐生成C.都是氧化还原反应D.反应中都无电子转移3.某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+完全氧化。x值为( )A.0.80B.0.85C.0.90D.0.93
知识回顾1.硫在自然界以游离态和化合态的形式存在。硫的游离态物质:硫单质(火山喷口、地壳岩层)硫的化合态物质:硫的氢化物(H2S)、硫的氧化物(SO2、SO3)、硫酸(H2SO4)、硫酸盐(Na2SO4、CaSO4·2H2O)、煤和石油中、蛋白质中等等2.硫单质俗称硫磺,通常情况下,它是一种黄色或淡黄色固体,很脆,易研成粉末;不溶于水,微溶于酒精,易溶于二硫化碳,熔点、沸点都不高。3.当硫与强还原剂(金属、氢气、碳等)反应时,表现氧化性。(硫元素化合价降低)当硫与氧气等强氧化剂反应时,表现还原性。(硫元素化合价升高)
1.把研细的硫粉和铁粉按照一定比例混合均匀,放在石棉网上堆成条状或如图所示形状。用灼热的玻璃棒触及一端,当混合物呈红热状态时移开玻璃棒,观察发生现象。2.取少量硫粉放入燃烧匙中,将燃烧匙放在酒精灯上加热至硫粉熔化并燃烧后,迅速伸入盛满氧气的集气瓶中(瓶底装有少量水),观察现象。3.什么叫同素异形体?4.硫的用途有哪些?
1.下列物质中的S元素只具有还原性的是亚硫酸钠、硫化氢、硫、三氧化硫、硫酸钠2.温度计玻璃泡打碎,其中水银掉落地上,你怎么处理?
五、不同价态硫元素之间的转化
知识回顾当硫元素处于中间价态时,含有这种价态硫元素的物质(硫磺、二氧化硫、亚硫酸钠),既具有氧化性又具有还原性;当硫元素处于最高价态时,含有这种价态硫元素的物质(三氧化硫、浓硫酸),只具有氧化性;当硫元素处于最低价态时,含有这种价态硫元素的物质(硫化氢、硫化钠),只具有还原性。
硫元素化合价有-2、0、+4、+6价,哪些含硫元素的物质只有氧化性?哪些含硫元素的物质只有还原性?哪些含硫元素的物质既有氧化性又有还原性?
据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫磺)能化金银钢铁,奇物”,所得产物不可能是( )A.Au2S B.Ag2S C.CuS D.FeS
知识回顾二氧化硫化学性质1.与水反应 SO2+H2O=H2SO32.与碱反应生成盐和水 SO2+2NaOH=Na2SO3+H2O3.氧化性 SO2+2H2S=3S↓+2H2O4.还原性 5.漂白性 能使品红溶液褪色(该性质用来检验SO2)。二氧化硫具有漂白性。用二氧化硫漂白过的有色物质,在一定条件下会恢复原来的颜色。
1.硫化氢有毒,做实验时应注意什么?2.怎么理解可逆反应?3.燃烧匙里的硫正在燃烧,你怎么去熄灭它?4.二氧化硫是酸性氧化物吗?
1.下列溶液中滴入几滴石蕊试液,最终变红的是( )A.新制氯水B.Na2CO3水溶液C.SO2水溶液D.NaCl水溶液2.下列实验能说明SO2具有漂白作用的是( )A.SO2气体能使溴水褪色B.SO2能使酸性高锰酸钾溶液褪色C.SO2气体能使含NaOH的酚酞溶液褪色D.SO2气体能使黄色的草帽辫变白色3.二氧化硫的下列化学性质中,体现二氧化硫作为还原剂的是( )A.SO2在一定条件下与O2反应转化为SO3B.通入品红溶液中,使品红褪色C.溶于水形成不稳定的亚硫酸D.与碱液反应生成亚硫酸盐
知识回顾1.硫酸是化学实验室中的重要试剂,也是重要的化工原料。制造化肥、农药、炸药、燃料等 用于石油精炼 用于金属加工2.浓硫酸具有脱水性,能按水的元素组成质量比脱去纸屑、棉花所含有机化合物中的氢、氧元素,使这些有机化合物炭化。3.浓硫酸表现出氧化性、酸性;二氧化硫表现出漂白性、酸性氧化物性质4.浓硫酸可以做干燥剂。
1.如何制取少量二氧化硫气体?2.冷的浓硫酸为什么能用铁质或铝质容器储存?3.下列可用浓H2SO4干燥的气体有( )①H2 ②SO2 ③H2S ④Cl2 ⑤NH3 ⑥HCl ⑦CO2 ⑧HBr ⑨COA.①②④⑥⑧⑨ B.①②④⑥⑦⑨C.①②④⑥⑦⑧ D.全部
1.下列有关浓硫酸的叙述,正确的是( )A.有脱水性,能夺取纸张中的水分子使之碳化B.有吸水性,可以用来干燥某些非碱性的气体,如:O2、HCl、CO2C.有难挥发性,可与挥发性酸的盐反应制取相应气体,如:HF、HID.有强氧化性,可以将H2S、SO2气体氧化2.浓硫酸在下列反应中只表现出酸性的是( )A.C + H2SO4B.Cu + H2SO4C.Fe + H2SO4 (冷)D.CuO + H2SO4
知识回顾1.pH<5.6的雨水称为酸雨。2.煤、石油中含有硫元素,故煤和石油燃烧会产生二氧化硫物质。3.排放到空气中的二氧化硫在氧气和水蒸气的共同作用下形成酸雾,随雨水降落就成酸雨。4.酸雨危害使湖泊的水变质→水生生物死亡浸渍土壤→变得贫瘠腐蚀建筑→建筑变得面目全非渗入地下水→危害人体健康酸雨侵蚀森迷→大面积死亡5.酸雨防治改变能源结构,开发利用清洁能源。控制酸性物质的排放健全法律法规,严格规定污染物排放标准
6.活化氮的量大大增加原因①化石燃料的消耗量急剧增加②化学合成氮肥的量迅速上升③豆科植物的栽种面积在扩大④人类的固氮活动7.含氮物质主要来源①化石燃料的燃烧②植物体的焚烧③农田土壤和动物排泄物中含氮化合物的转化④水体中氮元素来源于工业废水、生活污水、农田灌溉及水产养殖所投入的肥料和饵料8.含氮物质对环境影响①形成光化学烟 ②形成雾霾③形成酸雨④造成水体富营养化9.减少人类活动对氮循环和环境的影响措施①控制进入大气、土壤和水体中含有氮元素的物质的量②增强生态系统对含有氮元素的物质的吸收能力
酸雨是当今世界面临的一个重大的环境问题,SO2和NO2都能溶于水形成酸雨而破坏环境。请回答下列问题:(1)酸雨通常是指降水的pH<____,则该酸雨中收集该酸雨,露置于空气中,一段时间后发现pH值变小了,试用化学方程式解释:______。(2)为减少酸雨的产生,有下列措施:①少用煤作燃料;②把工厂的烟囱建高;③在酸化的土壤中加水;④燃料脱硫;⑤开发新能源。其中有效的措施是_______。A.①②③ B.①④⑤ C.①③④ D.②③④
知识回顾1.自然界中氮以游离态和化合态的形式存在。2.氮的固定概念:将空气中游离态的氮转化为含氮化合物的过程氮的固定方式:自然固氮(包括生物固氮、闪电固氮)、人工固氮(包括合成氨、仿生固氮)3.氮气物理性质
氮气化学性质 氮气在常温下化学性质不活泼,很难与其他物质反应。 在放电条件下 2N2 + O2 == 2NO
一氧化氮化学性质2NO + O2 = 2NO2(气体由无色变为红色,可用来检验NO存在)一氧化氮是还原剂,氧气是氧化剂
二氧化氮化学性质3NO2+H2O===2HNO3+NO→工业制取硝酸红棕色气体逐渐变为无色
3NO2+H2O=2HNO3+NO 反应中,(1)NO2是酸性氧化物吗?(2)n(氧化剂) : n(还原剂)=?(3)如何使尽可能多的NO2被水吸收转化为硝酸?
1.关于NO的下列叙述不正确的是A.NO可以是某些低价含氮物质的氧化产物;B.NO属于一种大气污染物,易结合血红蛋白使人中毒;C.NO是汽车尾气废气排放产生的污染之一;D.NO是红棕色气体2.下列转化不属于固氮的是A.雷雨时氮气转化为氮氧化合物B.氨气催化氧化生成NOC.豆科植物把游离态的氮变成氨D.工业上氮气、氢气合成氨气3.最新的病毒学研究证实,一氧化氮对“非典”病毒的抑制作用明显。下列关于一氧化氮的说法正确的是A.一氧化氮是酸性氧化物B.一氧化氮只能通过人工合成C.一氧化氮是大气污染物,会形成酸雨D.一氧化氮可用向下排空气法收集
知识回顾1.氮肥能够促进作物生长,并提高作物中蛋白质的含量。2.氨是无色、有刺激性气味的气体;在标准状况下,密度比空气小,极易溶于水且能快速溶解。3.①氨气溶于水时,大部分氨气与水结合成一水合氨,反应的化学方程式为:NH3+H2O NH3·H2O→化合反应→氮元素化合价不改变②NH3·H2O是一元弱碱③NH3·H2O不稳定,受热易分解NH3·H2O NH3↑+H2O →分解反应→氮元素化合价不改变
4.氨与氯化氢反应①化学方程式:NH3+HCl=NH4Cl(氮元素化合价没有改变,属于化合反应)②反应现象:有白烟生成③氨+酸→盐④注意:浓盐酸、浓硝酸等挥发性酸遇氨会产生白烟,利用这点可以检验浓氨水或氨的存在。硫酸等难挥发性酸虽能与氨反应生成铵盐,但不会产生白烟。
5.氨中氮元素的化合价为最低价,因此氨具有还原性,能与具有氧化性的物质发生反应。4NH3+5O2 4NO+6H2O
6.铵盐什么是铵盐?由铵根离子和酸根离子形成的化合物叫铵盐。②.铵盐受热会分解成哪些物质?NH4HCO3 NH3↑+CO2↑+H2ONH4Cl NH3↑+HCl↑
7.制取氨气注意事项硝铵受热分解易发生爆炸;硫酸铵与熟石灰反应生成的硫酸钙呈块状,不利于氨气的逸出,且反应后试管难清洗。氢氧化钠易吸水结块,对玻璃的腐蚀性较强。2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O氨气易溶于水,不能用排水法收集;密度比空气小,用向下排空气法收集。固固加热型用碱石灰干燥氨气。将湿润的红色石蕊试纸放在试管口,若变蓝则收集满。用蘸取浓盐酸的玻璃棒靠近试管口,若有白烟生成则收集满。多余的氨气需要吸收掉,在试管口放一团用水或稀硫酸浸湿的棉花。
1.液氨是纯净物吗?2.化学氮肥如何分类?3.氮肥作用是什么?4.将氨气分别转化为氨水、氯化铵,需要借助怎样的化学反应?5.如何将氨气转化为硝酸?6.从物质类别和氮元素化合价的角度总结氨气的性质。7.从离子反应的角度认识铵盐与碱溶液的反应,总结铵离子的检验方法。8.总结铵盐的性质。9.在实验室里如何获取氨气?10.铵根如何检验?
1.施用氮肥能促进作物生长,并能提高作物中蛋白质的含量。下列关于氮肥的说法错误的是( )A.尿素CO(NH2)2是一种氮肥B.储存碳酸氢铵时,应密封并置于阴凉通风处C.铵态氮肥不能与碱性物质如草木灰等混合施用D.氮肥溶于水,其中的氮元素均以铵离子形式在存2.有关铵盐性质的叙述正确的是( )A.都是晶体,都能溶于水 B.受热时分解,都有NH3产生C.与碱共热时不一定产生氨气D.都能与酸反应3.下列有关氨的性质的叙述中,正确的是( )A.氨水是一种强碱 B.氨气和酸都能在空气中相遇产生白色烟雾C.液氨常用来做致冷剂 D.氨的分子结构呈正四面体
知识回顾物理性质纯净的硝酸是无色、易挥发、有刺激性气味的液体;熔点-42℃,沸点83℃,密度1.5g/cm3, 硝酸质量分数为95%以上的浓硝酸,在空气中挥发出硝酸蒸气会产生“发烟”现象,通常又叫作发烟硝酸。
硝酸化学性质①硝酸属于强酸,具有酸的通性与指示剂作用:稀硝酸使紫色石蕊溶液变红;浓硝酸使紫色石蕊溶液先变红后褪色与碱发生中和反应:NaOH+HNO3=NaNO3+H2O与碱性氧化物反应:CuO+2HNO3=Cu(NO3)2+H2O与盐反应:CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑②硝酸的不稳定性4HNO3 4NO2↑+O2↑+2H2O
③强氧化性铜与硝酸反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O金属+硝酸→高价金属硝酸盐+NO或NO2+水
④与非金属单质反应4HNO3(浓)+C CO2↑+4NO2↑+2H2O加热条件下,浓硝酸能将碳等非金属单质氧化到最高价态。
1.硝酸用途有哪些?2.实验室如何保存硝酸?3.硝酸利弊是什么?
高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课前预习ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课前预习ppt课件,共21页。PPT课件主要包含了交流与思考,牛刀小试,思考与交流,离子大量共存等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课文内容ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册第3节 氧化还原反应课文内容ppt课件,共10页。PPT课件主要包含了物质的分类,胶体的性质,电解质和非电解质,离子方程式的意义,氧化还原反应等内容,欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序教课课件ppt: 这是一份鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序教课课件ppt,共11页。PPT课件主要包含了知识网络,要点排查等内容,欢迎下载使用。













