

所属成套资源:新鲁科版物理必修第一册PPT课件整册
高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量课文配套ppt课件
展开
这是一份高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量课文配套ppt课件,文件包含气体摩尔体积pptx、气体摩尔体积swf等2份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
分子、原子、离子、某些粒子的特定组合
无论是实验室或生产中都是使用它的体积而不是质量。那么,物质的量与气体体积之间有什么关系呢?
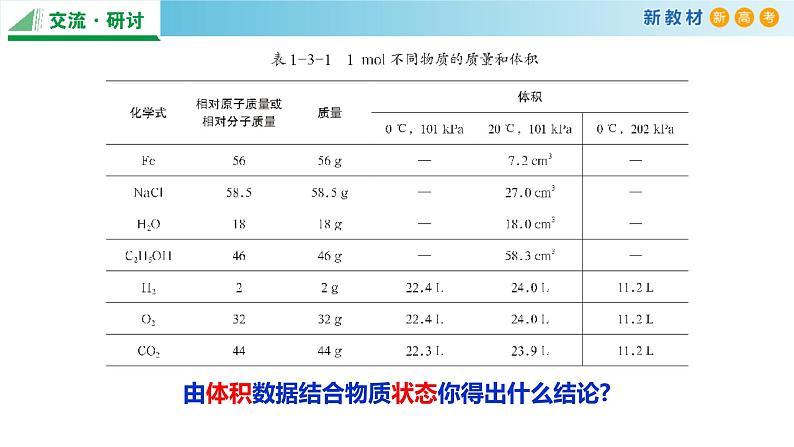
由体积数据结合物质状态你得出什么结论?
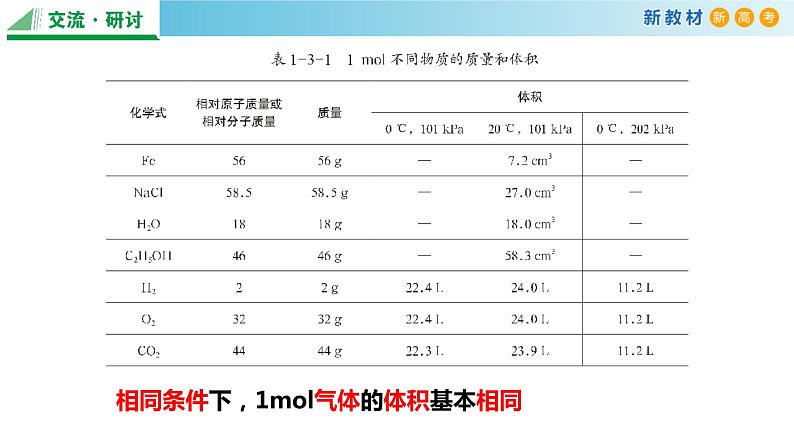
相同条件下,1ml气体的体积基本相同
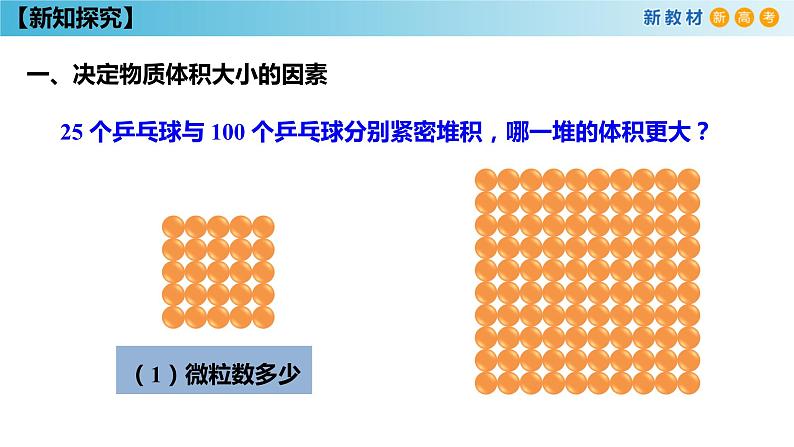
一、决定物质体积大小的因素
25 个乒乓球与 100 个乒乓球分别紧密堆积,哪一堆的体积更大?
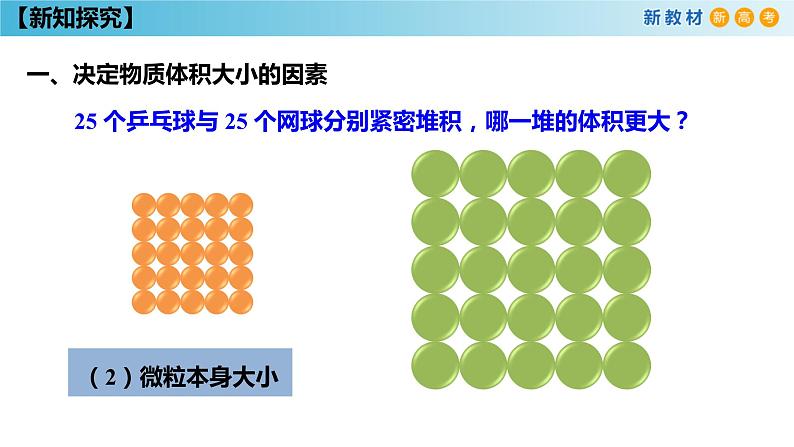
25 个乒乓球与 25 个网球分别紧密堆积,哪一堆的体积更大?
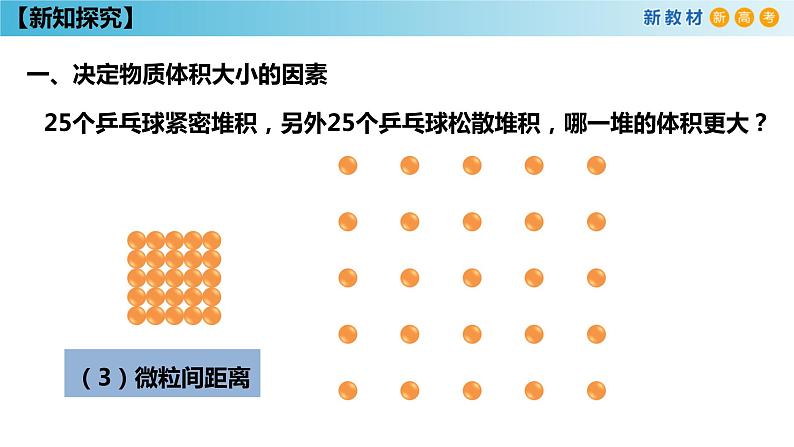
25个乒乓球紧密堆积,另外25个乒乓球松散堆积,哪一堆的体积更大?
微粒数的多少微粒本身的大小微粒间的距离
决定固、液、气体积的微观因素
固体和液体粒子间的距离非常小,它们的体积主要取决于粒子的 和 。
气体粒子间的距离远远大于粒子本身的直径。 气体体积主要取决于粒子的 和粒子的 。
0 C,1 ml H2O,18 mL
100 C,101.325 kPa1 ml H2O,3.06 104 mL
气体分子间距受哪些因素影响?
二、气体摩尔体积(Vm)
思考:类比摩尔质量,能否给出气体摩尔体积的定义?
一定的温度和压强下,1 ml 任何气体所占的体积。
3. 单位: 。
L · ml-1 或 m3 · ml-1
例如:标准状况(0 ℃,101 kPa)下[STP], 气体摩尔体积约为 22.4 L/ml 。
4. 取值: 。
一定 T、p下,Vm 的数值是固定不变的。
22.4 L · ml-1
(1)适用范围:任何气体 (混合气体或者纯净气体)。
(2)状况:一定温度和压强下,通常用标准状况。
(3)定量:1 ml 。
(4)Vm=22.4 L · ml-1 的成立条件: 标准状况下。
0 ℃、101 kPa
(7)并不是只有标准状况下, Vm =22.4 L · ml-1 。
(5)22.4 L · ml-1为近似值。
(6)比较气体体积必须指明温度和压强。
例1 下列关于物质体积影响因素的叙述中不正确的是 A.1 ml固态或液态物质的体积主要取决于它们的粒子大小B.1 ml气态物质的体积的大小主要取决于气体粒子间的距离C.同温同压下,任何气体粒子间的距离都近似相等D.同温同压下,粒子(或分子)数相同的任何物质的体积都相同
解析 同温同压下,粒子(或分子)数相同的任何固态或液态物质的体积不相同,而气态物质的体积相同。
例2 下列叙述正确的是 A.1 ml任何气体的体积都为22.4 LB.1 ml任何物质在标准状况下所占的体积都为22.4 LC.只有在标准状况下,气体摩尔体积才约为22.4 L·ml-1D.标准状况下,22.4 L任何气体的物质的量都是1 ml
解析 A中没有指明物质所处的温度、压强;B中没有指明物质的状态;C中在非标准状况下,气体的摩尔体积也可能是22.4 L·ml-1。
(1)气体摩尔体积只适用于单一气体或混合气体。标准状况下固体或液体的摩尔体积不是22.4 L·ml-1。(2)气体摩尔体积与压强和温度有关。常温常压下气体摩尔体积不是22.4 L·ml-1,非标准状况下,气体摩尔体积有可能为22.4 L·ml-1。
例3 设NA表示阿伏加德罗常数的值,下列叙述中正确的是 A.常温常压下,11.2 L CO2所含的原子数为1.5NAB.常温常压下,48 g O3含有的氧原子数为3NA C.标准状况下,22.4 L H2O所含分子数为NAD.标准状况下,22.4 L H2所含原子数为NA
解析 常温常压(非标准状况)下,11.2 L CO2的物质的量不是0.5 ml,所含原子数不是1.5NA;48 g O3的物质的量为1 ml,所含氧原子数为3NA;标准状况下H2O为液态,不能用气体摩尔体积计算其物质的量;标准状况下22.4 L H2的物质的量为1 ml,所含氢原子数为2NA。
——使用“22.4 L·ml-1”要“三看”
(1)看所处条件:必须为标准状况。非标准状况下,1 ml气体的体积不一定是22.4 L。(2)看物质状态:必须为气态。如标准状况下水、酒精、四氯化碳等为非气态物质。(3)看数值单位:单位是L·ml-1,而不是L;数值“22.4”为近似值。
同温同压下,相同体积的任何气体都含有相同数目的分子。
阿伏加德罗定律常用推论
例4 下列叙述正确的是 A.同温同压下,相同体积的物质,其物质的量必然相等B.任何条件下,等物质的量的氧气和一氧化碳所含的分子数必然相等C.1 L一氧化碳气体一定比1 L氧气的质量小D.同温同压下,等体积的物质所含的分子数一定相等
解析 只有气态物质才符合阿伏加德罗定律——在同温同压下,具有相同体积的气体的物质的量相等;具有相同物质的量的两种由分子构成的物质具有相同的分子数;因温度、压强不能确定, 1 L 一氧化碳和1 L氧气的物质的量大小不能确定,二者的质量大小无法比较。
例5 两个体积相同的密闭容器,一个盛有氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的 ①质量 ②密度 ③分子总数 ④原子总数A.①② B.②④C.③④ D.①③
解析 同温同压下,两个容器体积相同,则所含的分子数相同,又因HCl、H2、Cl2都是双原子分子,故原子总数也相同,但质量、密度不一定相同。
相关课件
这是一份高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量示范课ppt课件,共15页。
这是一份高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量教案配套课件ppt,共14页。PPT课件主要包含了课堂探究等内容,欢迎下载使用。
这是一份高中化学第三节 物质的量教学演示课件ppt,共27页。PPT课件主要包含了夯基提能·一遍过,相同体积,相同数目,物质的量,分子数,摩尔质量,答案C,答案D,答案B,单位物质的量的气体等内容,欢迎下载使用。










