



高中化学鲁科版 (2019)选择性必修2第1节 原子结构模型说课课件ppt
展开
这是一份高中化学鲁科版 (2019)选择性必修2第1节 原子结构模型说课课件ppt,共51页。PPT课件主要包含了原子轨道,随堂演练知识落实,课时对点练,内容索引,pdf,空间运动,+3+5=32,+3+5+7=42,运动状态,不存在等内容,欢迎下载使用。
1.知道描述原子核外电子运动状态的四个量子数的含义。2.理解用四个量子数描述原子核外电子的运动状态。3.了解原子轨道和电子云的含义。
二、原子轨道的图形描述与电子云图
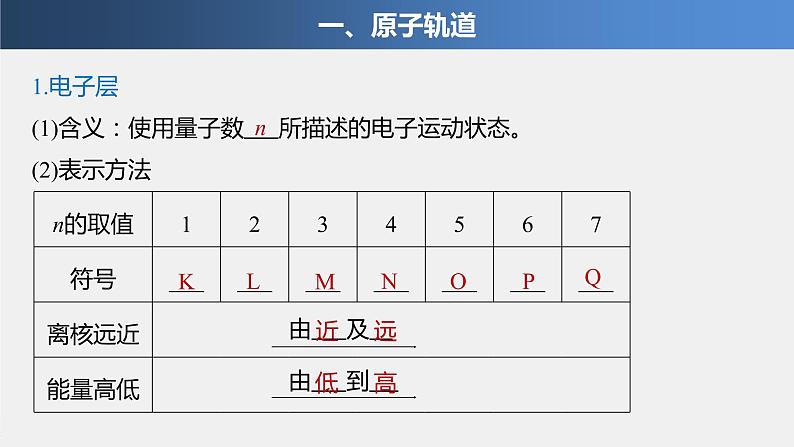
1.电子层(1)含义:使用量子数 所描述的电子运动状态。(2)表示方法
由 及
由 到
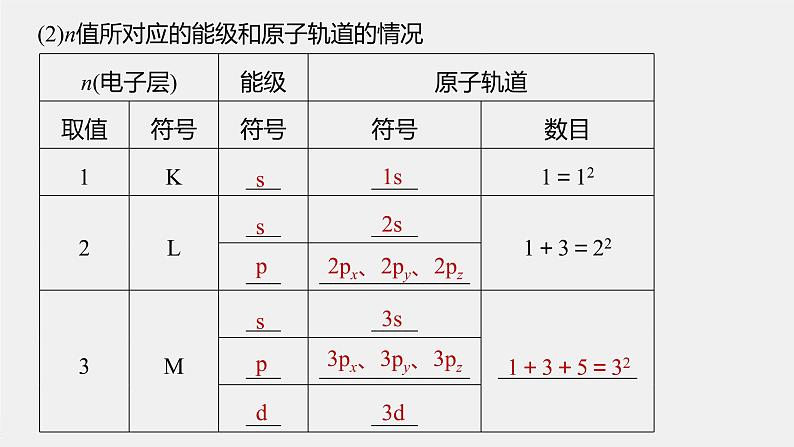
2.能级当n相同时,电子所具有的能量可能 ,即同一电子层可分成不同的 ,当n=x时,有 个能级,分别用符号 等表示。如:(1)当n=2时,有 个能级,符号分别为 ;(2)当n=3时,有 个能级,符号分别为 ;(3)当n=4时,有 个能级,符号分别为 。3.原子轨道(1)概念:原子中的单个电子的 状态。
(2)n值所对应的能级和原子轨道的情况
2px、2py、2pz
3px、3py、3pz
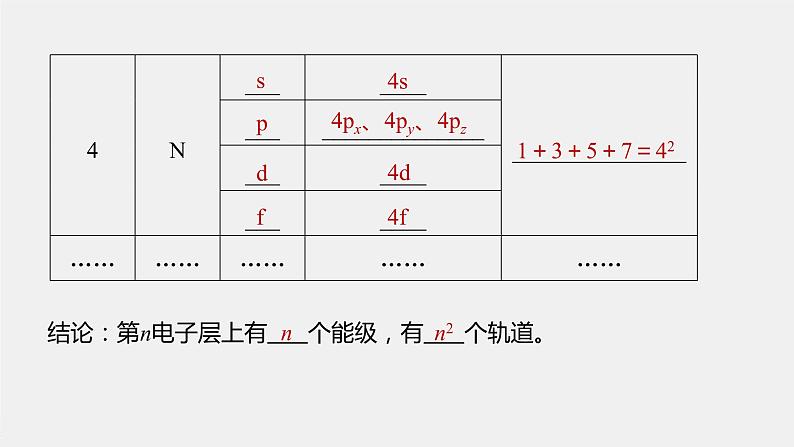
结论:第n电子层上有 个能级,有 个轨道。
4px、4py、4pz
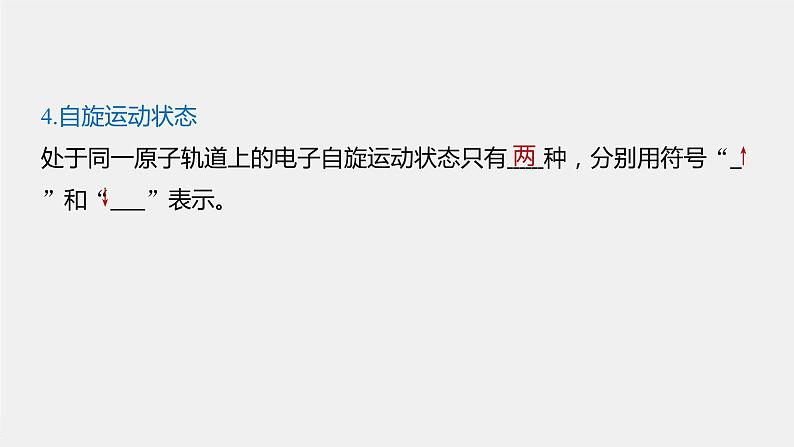
4.自旋运动状态处于同一原子轨道上的电子自旋运动状态只有 种,分别用符号“ ”和“ ”表示。
(1)离核越近的电子,能量越低( )(2)第三电子层有s、p共两个能级( )(3)当电子层数n=2时,有2s、2px、2py、2pz四个原子轨道( )(4)各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7( )(5)各电子层的能级都是从s能级开始至f能级结束( )(6)处于s能级的电子能量一定比处于p能级的电子能量低( )
1.原子核外电子的运动状态决定因素有_____________________________ 。Na原子核外有 个电子,有 种运动状态,即一个原子中 (填“存在”或“不存在”)运动状态相同的电子。2.电子层数n=5时,该层电子的空间运动状态有 种,原子轨道总数___个,s能级的表示符号为 。3.比较下列多电子原子的原子轨道的能量高低。(1)2s________3s;(2)2s________3d;(3)3p________3s;(4)3px________3pz。
电子层、能级、原子轨道、自旋
(1)电子层数(n)、能级数、原子轨道数、容纳电子数的关系
(2)不同原子轨道能量高低的关系
即决定原子核外电子能量的是电子层和能级。
1.原子轨道的图形描述(1)对象:原子中单个电子的 。(2)方法:用 标注。(3)意义:表示原子轨道的 。
(4)形状:s轨道呈 ,具有 对称性;p轨道在空间的分布特点是分别相对于x、y、z轴对称,呈哑铃形(∞)。如图
2.电子在核外的空间分布(1)原子核外电子的运动特点与对宏观物体运动的描述不同,微观粒子如电子的质量很小(9.1×10-31 kg),运行速度极快,运行空间极小,人们不可能同时准确测定它的 和 ,只能通过波函数进行数学处理计算出电子在某个地方出现的 。(2)电子云图①概念:描述电子在原子核外空间某处单位体积内的 分布的图形。②电子云图的形状:s能级的电子概率分布呈 形,p能级的电子概率分布呈哑铃形,有 种空间伸展方向。③含义:用单位体积内小点的疏密程度表示电子在原子核外某处单位体积内出现 的大小。
④意义:电子云不仅表示电子在空间单位体积内出现的概率,同时说明量子力学中轨道的含义与玻尔轨道的含义完全不同,它既不是圆周轨道,也不是其他经典意义上的固定轨迹。
(1)电子云中的每一个小点就是一个电子( )(2)s电子绕核旋转,其轨道为一圆圈,而p电子绕核做“∞”形运动( )(3)电子云界面图中的小点越密表示该核外空间的电子越多( )(4)钠原子的1s、2s、3s电子云半径相同( )易错提醒 s轨道为球形,p轨道为“∞”形,并不是说s能级电子绕核做圆周运动,p能级电子绕核做“∞”形运动。
1.3px所代表的含义是A.px轨道上有3个电子B.第三电子层px轨道有3个伸展方向C.px电子云有3个伸展方向D.第三电子层沿x轴方向伸展的p轨道
解析 3px中,3表示第三电子层,p原子轨道在空间的分布分别沿x、y、z轴三个方向,px表示沿x轴方向伸展的p轨道。
2.观察1s轨道电子云图,判断下列说法正确的是A.1个小点表示1个自由运动的电子B.1s轨道的电子云形状为圆形的面C.电子在1s轨道上运动像地球围绕太阳旋转D.1s轨道电子云的点的疏密表示电子在某一位置出现概率的大小
解析 1s轨道的电子云呈球形对称,用点的疏密表示电子出现的概率的大小。
3.下面是s能级和p能级的原子轨道图,下列说法正确的是
解析 每个s能级有1个原子轨道,s电子原子轨道是球形的,随着电子层数的增大,其半径也逐渐增大。p电子原子轨道是轴对称的,每个p能级有3个相互垂直的原子轨道,p电子原子轨道的平均半径也随着电子层数的增大而增大。
A.s电子的原子轨道呈圆形B.每个s能级有2个原子轨道C.每个p能级有3个原子轨道D.原子轨道的半径与电子层数无关
(1)原子轨道①同一电子层,不同能级其原子轨道形状不同,数目不同,能量不同。②不同电子层,同种能级其原子轨道形状相似,半径不同,能量不同。③s能级只有1个原子轨道,p能级有3个原子轨道,它们互相垂直,分别以px、py、pz表示。(2)电子云图①电子云图中的小点不代表电子。小点疏密程度表示电子在原子核外出现概率的大小。②离核越近,电子出现的概率越大,电子云越密集。如1s电子云比2s电子云更密集,2s电子云比1s电子云疏散。
1.下列说法中正确的是A.电子云通常是用小黑点来表示电子的多少B.处于最低能量的原子叫基态原子C.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动D.电子仅在激发态跃迁到基态时才会产生原子光谱
解析 A项,电子云通常用小黑点表示单位体积内电子出现概率的大小;C项,电子离核由近到远,能量由低到高;D项,电子在基态跃迁到激发态时也会产生原子光谱。
2.下列能级中原子轨道数为3的是A.s能级 B.p能级C.d能级 D.f能级
解析 s能级中原子轨道数为1,p能级中原子轨道数为3,d能级中原子轨道数为5,f能级中原子轨道数为7。
3.下列说法中正确的是A.1s、2px、2py、2pz轨道都具有球对称性B.因为p轨道是“∞”字形的,所以p电子也是“∞”字形C.氢原子中只有一个电子,故氢原子只有一个轨道D.原子轨道与电子云图都是用来形象描述电子运动状态的
解析 s轨道是球形对称的;p轨道呈哑铃形,px、py、pz分别相对于x、y、z轴对称;氢原子中只有一个电子,填充在1s轨道上,但也存在其他空轨道,使电子跃迁,产生光谱。
解析 同一电子层上p电子能量高于s电子能量,不同电子层上p电子能量不一定高于s电子能量,如3s>2p。
4.下列有关说法错误的是A.s电子的原子轨道都是球形的,2s电子比1s电子能量高且电子云比1s更 扩散B.p电子的原子轨道都是哑铃形的,每个p能级有3个原子轨道,它们相互 垂直,能量相同C.p电子能量一定高于s电子能量D.处于同一原子轨道的电子,自旋状态有两种
5.下列有关认识正确的是A.各能层的能级数按K、L、M、N分别为1、2、3、4B.各能层的能级都是从s能级开始至f能级结束C.各能层含有的能级数为n-1D.各能层含有的电子数为2n2
解析 各能层中的能级数等于其所处的能层数,即当n=1时,它只有一个s能级,当n=2时,含有两个能级分别为s、p能级,所以B、C都不正确;D选项中每个能层最多能填充2n2个电子,但不是一定含有2n2个电子。
6.填空。(1)用符号填写电子层所含能级种类:K层:___;L层:_______;M层:__________;N层:______________。(2)用数字填写能级所含原子轨道数目:s:____;p:____;d:____;f:___。(3)用相应的符号描述在n=2的电子层上所有的原子轨道__________________,当该层充满电子时,有___种形状不同的电子云。
4s、4p、4d、4f
2s、2px、2py、
(4)比较下列原子轨道的能量高低(填“<”“=”或“>”)。①4s________3s________2s________1s;②2px________2py________2pz;③4f________4d________4p________4s;④1s________2p________3d________4f;⑤2px________3py________4py。
一、单项选择题1.下列各电子层中不包含p能级的是A.M电子层 B.N电子层C.L电子层 D.K电子层
解析 K电子层只包括s能级,L电子层包括s、p能级,M电子层包括s、p、d能级,N电子层包括s、p、d、f能级。
2.下列各能级的原子轨道中,可容纳电子数最多的是A.5d B.6p C.4f D.7s
解析 s、p、d、f能级分别含有1、3、5、7个原子轨道,每个原子轨道最多容纳2个电子,所以4f轨道容纳电子数最多。
解析 电子的自旋不是“自转”;原子轨道可用来描述原子中单个电子的空间运动状态,它只能描述核外电子高频出现的“区域”,而不是核外电子运动的轨迹;第二电子层有四个轨道,分别为2s、2px、2py、2pz。综上所述,B项正确。
3.下列有关核外电子运动状态的说法正确的是A.电子自旋就是电子围绕轴“自转”B.原子轨道可用来描述核外电子的运动状态C.第二电子层有自旋相反的两个轨道D.原子轨道可用来描述核外电子的运动轨迹
4.下列有关电子层和能级的叙述中正确的是A.M电子层有s、p共2个能级,最多能容纳8个电子B.3d能级最多容纳5个电子,3f能级最多容纳7个电子C.无论哪一电子层的s能级最多容纳的电子数均为2D.任一电子层都有s、p能级,但不一定有d能级
解析 A项,M电子层有s、p、d共3个能级,最多容纳18个电子;B项,3d能级最多容纳10个电子且不存在3f能级;D项,K电子层只有s能级,不含有p能级。
5.电子层为第N层的所含能级数、原子轨道数和最多容纳电子数分别为A.3、9、18 B.4、12、24C.5、16、32 D.4、16、32
解析 第N层即第四电子层含有4个能级,16个原子轨道,最多容纳的电子数为32个。
6.下列各组多电子原子的原子轨道能量高低比较中,错误的是A.2s<2p B.3px<3pyC.3s<3d D.4s>2p
解析 同一能级上各原子轨道的能量相同,3px=3py,B错误。
7.下列电子层中,原子轨道的数目为4的是A.K层 B.L层C.M层 D.N层
解析 电子层为n时,轨道数为n2,故可知该层为第二层即L层,B正确。
8.下列有关电子云的叙述中,正确的是A.电子云形象地表示了电子在核外某处单位体积内出现的概率B.电子云直观地表示了核外电子的数目C.1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率 为零D.电子云是电子绕核运动形成的一团带负电荷的云雾
解析 为了形象地表示电子在原子核外空间的分布状况,人们常用小点的疏密程度来表示电子在原子核外出现概率的大小;点密集的地方,表示电子出现的概率大;点稀疏的地方,表示电子出现的概率小,这就是电子云。1s电子云界面以外,电子出现的概率不为零,只是出现的概率很小。
9.(2019·邢台市月考)图1和图2 分别是1s电子的概率密度分布图和原子轨道图。下列有关说法正确的是A.图1中的每个小黑点表示1个电子B.图2 表示1s电子只能在球体内出现C.图2表明1s轨道呈球形,有无数对称轴D.图1中的小黑点表示电子在核外所处的位置
解析 电子云就是用小黑点的疏密来表示空间各电子出现概率大小的一种图形,小黑点表示空间各电子出现的几率, A、D错误。
二、不定项选择题10.下列有关电子云和原子轨道的说法正确的是A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云B.s轨道呈球形,处在该轨道上的电子只能在球壳内运动C.p轨道呈哑铃形,在空间有两个伸展方向D.与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大
解析 电子云仅表示电子在某一区域内出现的概率,并非原子核真被电子云雾所包裹,故A错误;原子轨道是电子出现的概率约为90%的空间轮廓,它表明电子在这一区域内出现的机会大,在此区域外出现的机会少,故B错误;p轨道在空间有x、y、z 3个伸展方向,故C错误。
解析 虽然s能级的原子轨道的形状都是球形,但按照1s、2s、3s、4s……的顺序,电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云向更大的空间扩展,原子轨道的平均半径逐渐增大,D项错误。
11.下列有关原子核外电子的能量与运动状态的说法正确的是A.在同一原子中,2p、3p、4p……能级的电子轨道数依次增多B.在同一能级上运动的电子,其能量一定相同C.在同一能级上运动的电子,其运动状态不相同D.在同一原子中,1s、2s、3s、4s……能级的原子轨道的平均半径相同
解析 2px、2py、2pz所表示的是同一能级中的三个不同的原子轨道,其能量相同;2px、2py、2pz的电子云,原子轨道都是哑铃形的,都是轴对称图形;在空间伸展方向上不同,D项正确。
12.对于钠原子的第二电子层的p轨道2px、2py、2pz间的差异,下列说法中正确的是A.电子云形状不同B.原子轨道的对称类型不同C.电子的能量不同D.电子云空间伸展方向不同
解析 在图中,电子在空间出现的概率分布关于z轴对称,电子云并不是电子的真实运动轨迹,C错误;2pz轨道电子云形状为两个椭圆球,而不是面,D正确。
13.观察2pz轨道电子云示意图(如图所示),下列说法中错误的是A.2pz轨道上的电子在空间出现的概率分布呈z轴对称B.点密集的地方表明电子出现的概率小C.电子先沿z轴正半轴运动,然后沿其负半轴运动D.2pz轨道的形状为两个椭圆球
三、非选择题14.(1)可正确表示原子轨道的是_____(填字母)。A.2s B.2d C.3p D.3f
解析 L电子层包括s、p能级,M电子层包括s、p、d能级,所以L层不存在2d轨道,M层不存在3f轨道,故选A、C。
(2)如图是s能级、p能级的原子轨道图,试回答问题:
解析 s轨道在三维空间分布呈球形,p轨道空间分布分别相对于x、y、z轴对称,原子轨道的半径与电子层数有关,并随电子层数的增大而增大。
①s能级的原子轨道呈____形,每个s能级有___个原子轨道;p能级的原子轨道分别相对于x、y、z轴______,每个p能级有___个原子轨道。②s能级原子轨道、p能级原子轨道的半径与_________有关,__________越大,原子轨道半径越大。
15.回答下列问题:(1)在基态多电子原子中,关于核外电子能量的叙述错误的是___(填字母)。a.最易失去的电子能量最高b.同一个电子层上的不同能级上的原子轨道,能量大小不同c.p轨道电子能量一定高于s轨道电子能量d.在离核最近区域内运动的电子能量最低
解析 能量越高的电子在离核越远的区域内运动,也就越容易失去,a项正确;多电子原子在第n层中不同能级的能量大小顺序为E(ns)<E(np)<E(nd)<E(nf),b项正确;同一电子层中的p轨道电子能量一定比s轨道电子能量高,但外层s轨道电子能量比内层p轨道电子能量高,c项不正确;离核越近,电子能量越低,d项正确。
(2)比较下列多电子原子的原子轨道的能量高低。①1s_____3d;②3s_____3p_____3d;③2p_____3p_____4p;④3px_____3py_____3pz。
解析 在多电子原子中,原子轨道能量的高低存在如下规律:①相同的原子轨道能量的高低:1s<2s<3s<4s……,3d<4d<5d……;②相同电子层上原子轨道能量的高低:ns
相关课件
这是一份化学第2节 原子结构与元素周期表教课课件ppt,共14页。
这是一份高中化学鲁科版 (2019)选择性必修2第1节 原子结构模型背景图课件ppt,共10页。
这是一份鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表教学课件ppt,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。









