






共价键与分子的空间结构PPT课件免费下载2023
展开
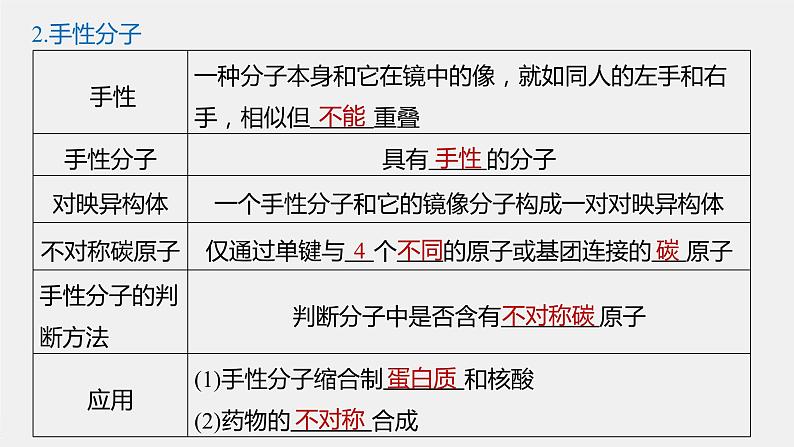
鲁科版 (2019)高中化学选择性必修2课文《共价键与分子的空间结构》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。
一、【学习目标】1.知道手性分子的概念,会判断不对称碳原子。2.理解共价键的极性、分子的空间结构与分子极性的关系,学会判断 简单分子极性的方法。二、【课程的主要内容】
(1)CH4分子是面对称( )(2)NH3和H2O分子是面对称( )(3)CH3—CH3分子是轴对称( )(4)分子的对称性对物质的化学性质有一定影响( )(5)手性分子中不对称碳原子的杂化方式为sp3 ( )
1.下列化合物中具有旋光性的是A.CCl2F2 B.CH3CH2OH
解析 手性分子具有旋光性,中心原子连有四个不同的原子或基团的化合物才具有手性。A项中C原子只连有Cl、F两种原子,故A项不是手性分子;
分子中两个C原子分别连有2种和3种不同的原子或基团,故B项不是手性分子;
分子中1、3号C原子结构对称,故2号C原子连有3种原子或基团,1、3号C原子均连有2个氢原子,即连有3种不同原子或基团,故C项不是手性分子;
分子中2号C原子连有—CH3、—H、—COOH、—OH四种不同的原子或基团,故D项是手性分子。
2.下列物质中不存在对映异构体的是A.BrCH2CHOHCH2OH
解析 若同一个碳原子上连接四个不同的原子或基团,则该碳原子称为不对称碳原子,含有不对称碳原子的分子为手性分子,存在对映异构体,D项中不存在对映异构体。
手性分子的理解(1)手性同分异构体(又称对映异构体、光学异构体)的两个分子互为镜像关系,即分子形式的“左撇子和右撇子”。(2)构成生命体的有机物绝大多数为手性分子。两个手性分子的性质不同,且大多数手性分子中含有不对称碳原子。(3)判断分子是否是手性分子常用的方法是判断有无不对称碳原子。
2.分子极性的判断方法分子的极性是由分子中所含共价键的极性与分子的空间结构两方面共同决定的。判断分子极性时,可根据以下原则进行:(1)只含有非极性键的双原子分子或多原子分子大多是 分子,如O2、H2、P4、C60。(2)含有极性键的双原子分子都是 分子,如HCl、HF、HBr。(3)含有极性键的多原子分子,空间结构 的是非极性分子;空间结构 的是极性分子。
3.对物质性质的影响(1)熔、沸点:在 的情况下,极性分子构成的物质比非极性分子构成的物质沸点 ,如沸点:N2 CO。(2)溶解性:极性分子易溶于 溶剂(如水),非极性分子易溶于______溶剂(如四氯化碳),这就是 原理中的一种类型。
(1)极性分子中可能含有非极性键( )(2)双原子单质分子都是非极性分子( )(3)非极性分子中不可能含有极性键,一定含有非极性键( )(4)非极性分子中只含有非极性键( )(5)所含共价键全部为极性键的分子,一定是极性分子( )
解析 根据价电子对互斥理论可得四种分子的结构如下: 、 、
1.下列分子中,属于非极性分子的是A.SO2 D.COCl2
、 。SO2、NH3分子中含有极性键,各键空间排列不对称,
为极性分子;C项,虽然分子中含有极性键,但各键的空间排列对称,为非极性分子;D项,分子中正负电荷的重心不重合,为极性分子。
2.下列分子是极性分子的是A.PCl3B.SO3C.BF3D.CS2
解析 PCl3中P的最外层有5个电子,其化合价为+3价,中心原子的化合价的绝对值不等于原子的最外层电子数,属于极性分子,A项符合题意;SO3中S的最外层有6个电子,其化合价为+6价,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,B项不符合题意;BF3中B的最外层有3个电子,其化合价为+3价,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,C项不符合题意;CS2中C的最外层有4个电子,其化合价为+4价,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,D项不符合题意。二、【例题剖析】
3.下列物质难溶于水的是A.SO2 D.C2H5OH
解析 SO2、HCHO、C2H5OH均为极性分子,根据相似相溶原理,它们均易溶于水,CCl4为非极性分子,难溶于水。
(1)判断分子极性的一般思路
(2)键的极性和分子极性的关系
(3)判断ABn型分子极性的经验规律①若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子。②若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3为极性分子。
1.下列各组物质中,都是由极性键构成的极性分子的是A.CH4和H2O B.CO2和HClC.NH3和H2S D.HCN和BF3
解析 极性键是存在于不同元素原子之间的共价键;极性分子是分子的正电中心和负电中心不重合的分子。NH3是呈三角锥形的极性分子;CO2是呈直线形的非极性分子;H2O、H2S都是呈V形的极性分子;HCl、HCN都是呈直线形的极性分子;CH4是呈正四面体形的非极性分子,BF3是呈平面三角形的非极性分子。
2.下列分子中,不含不对称碳原子的是
解析 如果一个碳原子连接四个不同的原子或基团,这样的碳原子叫不对称碳原子,B选项中的物质不含这样的碳原子。
C. D.CH3CHClCH2CHO
3.下列叙述正确的是A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心C.H2O是极性分子,分子中O原子不处在2个H原子连线的中央D.CO2是非极性分子,分子中C原子不处在2个O原子连线的中央
解析 NH3中的N原子以sp3杂化,形成三角锥形结构,电荷分布不对称,是极性分子;CCl4分子中C—Cl键为极性键,碳原子采取sp3杂化,且无孤电子对,分子空间结构为正四面体形,碳原子位于正四面体的中心;H2O分子中H—O键为极性键,氧采取sp3杂化,且有两对孤电子对,分子空间结构为V形,整个分子电荷分布不对称,为极性分子;CO2分子中碳采取sp杂化,分子空间结构为直线形,分子为非极性分子,碳原子位于2个氧原子连线的中央。
4.用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示,据此分析,A、B两种液体分子的极性正确的是A.A是极性分子,B是非极性分子B.A是非极性分子,B是极性分子C.A、B都是极性分子D.A、B都是非极性分子
解析 由图示用一带静电的玻璃棒靠近A时,A不偏转,说明A无极性,靠近B时,B偏转,说明B有极性。
5.在HF、H2O、NH3、CS2、CH4、N2分子中:(1)以非极性键结合的非极性分子是_____。(2)以极性键结合的具有直线形结构的非极性分子是_____。(3)以极性键结合的具有正四面体形结构的非极性分子是_____。(4)以极性键结合的具有三角锥形结构的极性分子是_____。(5)以极性键结合的具有sp3杂化轨道结构的分子是________________。
H2O、NH3、CH4
解析 HF是含有极性键的双原子分子,为极性分子;H2O中氧原子采取sp3杂化方式,与H原子形成极性键,为极性分子;NH3中有极性键,N原子采取sp3杂化,三角锥形结构;CS2与CO2相似,极性键、直线形非极性分子;CH4中C原子采取sp3杂化方式与H原子形成极性键,正四面体构型,非极性分子;N2是由非极性键结合的非极性分子。
6.回答下列问题:(1)双氧水(H2O2)是一种医用消毒杀菌剂,已知H2O2分子的结构如图所示,H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。试回答:①下列关于H2O2的说法中正确的是____(填字母)。a.分子中有极性键b.分子中有非极性键c.氧原子的轨道发生sp2杂化d.分子是非极性分子
解析 H2O2中H—O键为极性键,O—O键为非极性键,各键排列不对称,H2O2为极性分子,O原子价电子对数为 =4,O原子采取sp3杂化。
②H2O2分子的电子式为_____________。
③H2O2分子中氧元素的化合价为_______,原因是______________________________________________________________________________。
因为O—O键为非极性键,O—H键为极性键,共用电子对偏向于氧,故氧元素显-1价
解析 只有共用电子对发生的偏移才能决定元素在化合物中的化合价。
(2)已知白磷(P4)的结构如图所示,可知每个磷原子以____个共价键与另外的____个磷原子结合成正四面体形结构,它应该是______(填“极性”或“非极性”)分子,磷原子的杂化方式为________。
解析 P4分子中每个P原子与3个P原子以3个共价键结合成正四面体形结构,各键排列对称,属于非极性分子, P原子形成3个σ键,且有一对孤电子对,所以P原子采取sp3杂化。
解析 手性分子中应含有不对称碳原子,即同一个碳原子上连有四个不同的原子或基团,所以二者不是手性分子;二者的分子式相同,结构也相同,故二者是同一物质。四、【基础练习】
一、单项选择题1.如图所示,下列有关两分子的说法正确的是A.二者互为同分异构体B.二者是同一物质C.二者是手性分子D.二者互为同系物
解析 当一个碳原子所连接的四个原子或基团都不相同时,这个碳原子为不对称碳原子,具有不对称碳原子的分子既没有对称轴,也没有对称面,是不对称分子,没有对称性。D项中物质分子的结构可表示为 ,没有对称性。
2.下列物质的分子不具有对称性的是A.CH4 D.CH3CH(Cl)Br
3.下列化合物中含有不对称碳原子的是A.CCl2F2B.CH2OHCH(OH)CH2OHC.CH3CH2OHD.
解析 CCl2F2中碳原子上连有相同的原子,所以该碳原子不是不对称碳原子,故A项错误;CH2OHCH(OH)CH2OH中三个碳原子中每个碳原子都连有相同的原子或基团,所以该化合物不含不对称碳原子,故B项错误;CH3CH2OH分子中每个碳原子都连有相同的原子,所以其不含不对称碳原子,故C项错误;D项分子中连接羟基和羧基的碳原子上连有4个不同的原子或基团,所以该碳原子属于不对称碳原子,故D项正确。
4.下列有机物分子中属于手性分子的是①乳酸[CH3CH(OH)COOH] ②2 -丁醇 ③ ④丙三醇A.只有① B.①和②C.①②③ D.①②③④
解析 含有不对称碳原子的分子为手性分子。根据各分子的结构简式:
、 、 、 ,
可知①②③中存在不对称碳原子(用“*”标记的),而④中不存在不对称碳原子。
5.两种非金属元素A、B所形成的下列分子中,一定属于极性分子的是
A. B.B—A—B
解析 对于多原子分子是否是极性分子,取决于分子的结构是否对称,即正、负电荷的重心是否重合。A项中分子为正四面体形,结构对称,正、负电荷的重心重合,是非极性分子;B项中分子为直线形,结构对称,正、负电荷的重心重合,是非极性分子;C项中分子为平面三角形,结构对称,正、负电荷的重心重合,是非极性分子;D项中分子为三角锥形,结构不对称,正、负电荷的重心不重合,是极性分子。
解析 只有极性分子才能在电场中定向移动,非极性分子几乎不发生定向移动。水分子是由极性键构成的极性分子,故选D。
6.使用微波炉加热,具有使受热物质均匀、表里一致、速度快、热效率高等优点。其工作原理是通电炉内的微波场以几亿的高频改变电场的方向,水分子因而能迅速摆动,产生热效应。这是因为A.水分子具有极性共价键B.水分子中有共用电子对C.水由氢、氧两元素组成D.水分子是极性分子
7.经验规律(相似相溶规律):一般来说,由极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂。以下事实中可以用相似相溶规律说明的是A.HCl易溶于水 B.I2可溶于水C.Cl2可溶于水 D.NH3易溶于苯
解析 HCl、NH3是极性分子,I2、Cl2是非极性分子,H2O是极性溶剂,苯是非极性溶剂。
二、不定项选择题8.CO2、CH4、BF3都是非极性分子,SO2、H2O、NH3都是极性分子,由此推测ABn型分子是非极性分子的经验规律是A.所有原子在同一平面B.分子中每个键的键长应相等C.A的相对原子质量小于BD.在ABn中A原子没有孤电子对
解析 CO2、CH4、BF3的中心原子的所有电子都参与成键,没有孤电子对,都是对称结构,而SO2、H2O、NH3的中心原子上都有未参与成键的孤电子对,都不是对称结构。
9.下列说法正确的是A.由极性键构成的分子可能是非极性分子B.含非极性键的分子一定是非极性分子C.极性分子一定含有极性键,非极性分子一定含有非极性键D.以极性键结合的双原子分子,一定是极性分子
解析 由极性键构成的分子若空间结构对称,则分子是非极性分子,A项说法正确;含非极性键的分子也可能含有极性键,也可能是极性分子,如CH3CH2OH等,B项说法错误;CO2是由极性键形成的非极性分子,C项说法错误;以极性键结合的双原子分子都是极性分子,D项说法正确。
10.下列各组分子中,都是由极性键构成的极性分子的一组是A.CH4 Br2 B.H2O NH3C.CCl4 H2S D.CO2 HCl
解析 Br2是由非极性键构成的非极性分子,H2S、HCl、NH3和H2O是由极性键构成的极性分子,CH4、CCl4、CO2是由极性键构成的非极性分子。
11.下列各组分子属于含有非极性键的非极性分子的是A.CO2、H2S B.C2H4、CH4C.Cl2、C2H2 D.NH3、HCl
C项,Cl2只含非极性键,是非极性分子,C2H2含有碳碳非极性键,是非极性分子;D项,NH3、HCl为极性分子。
解析 A项,CO2的结构式为O==C==O,H2S的结构式为 ,都只含有极性键,CO2为非极性分子,H2S是极性分子;
B项,C2H4的结构式为 ,含有碳碳非极性键,是非极性分子,
CH4的结构式为 ,只含极性键,属于非极性分子;五、【扩展提升】
三、非选择题12.指出下列各组分子的极性和空间结构:(1)OF2______________________;BeF2___________________。
极性分子、V形(或角形)
解析 OF2为V形(或角形)结构,两个F原子不是对称地分布在中心原子O的周围,整个分子的正、负电荷重心不重合,是极性分子。而BeF2是直线形结构,两个F原子对称地分布在中心原子Be的周围,整个分子的正、负电荷重心重合,是非极性分子。
(2)PF3___________________;BF3_________________________。
(3)CF4________________________;SiF4_______________________。
非极性分子、平面正三角形
解析 PF3为三角锥形结构,是极性分子。BF3为平面正三角形结构,是非极性分子。
非极性分子、正四面体形
解析 CF4为正四面体形结构,是非极性分子。SiF4为正四面体形结构,是非极性分子。
13.下列物质结构图中, 代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表除形成共价键外的其他最外层电子,短线代表共价键,如F2: 。
(1)试写出四种图示所代表的分子式:A_____,B_____,C______,D__________。
(4)A、C分子中,中心原子以何种类型杂化轨道成键?其分子空间结构是什么形状?________________________________________________________________________________________________
(2)将题述四种物质的液体呈细流流下,用带静电的玻璃棒靠近细流,细流发生偏转的是___________________________(填分子式)。(3)写出B分子中极性共价键的类型和个数:_______________。
NH3分子中N原子以sp3杂化轨道成键,呈三角锥形;BF3分子中,B原子以sp2杂化轨道成键,呈平面正三角形
解析 本题综合考查共价型分子的相关知识。根据题给条件,判断出A、B、C、D四种物质分别为NH3、HCN、BF3、CO(NH2)2;其中,NH3、HCN、CO(NH2)2为极性分子,易被静电吸引或排斥而偏移,BF3为非极性分子;H—C≡N中,含1个C—H σ键,1个C—N σ键,2个π键。
14.在极性分子中,正电荷重心与负电荷重心间的距离称为偶极长,通常用d表示。极性分子的极性强弱与偶极长和电荷量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩是偶极长和电荷量的乘积,即μ=dq。在非极性分子中,其正、负电荷重心重合,故μ为0。试回答下列问题:(1)HCl、CS2、H2S、SO2四种分子中μ=0的有_____。
解析 HCl是由极性键形成的双原子极性分子;根据价电子对互斥理论可知,CS2是直线形分子,正、负电荷重心重合,为非极性分子,其偶极矩为0;H2S、SO2都是V形(或角形)结构,是极性分子,其μ>0。
(2)实验测得:μ(PF3)=1.03、μ(BCl3)=0。①由此可知,PF3分子的空间结构为_________;
解析 μ(PF3)=1.03说明PF3是极性分子,则PF3是三角锥形结构。
②BCl3分子的空间结构为____________,中心原子的杂化方式为_______。
解析 μ(BCl3)=0说明BCl3是非极性分子,其正、负电荷重心重合,应该是平面正三角形结构;中心原子B与3个Cl原子形成3个共价键(没有孤电子对),即B的杂化方式是sp2杂化。
(3)治癌药物Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的μ>0,淡黄色化合物的μ=0。试写出两种同分异构体的结构简式:__________、____________,在水中溶解度较大的是___________(填结构简式)。
解析 根据题意,Pt(NH3)2Cl2具有平面四边形结构,若μ=0,则为非极性分子,NH3和Cl分别对称分布在四边形的4个顶点上,即正、负电荷重
心重合,故淡黄色化合物的结构简式为 ;若μ>0,则为极性分
子,NH3和Cl在四边形的4个顶点上的分布是不对称的,即正、负电荷重
心不重合,故棕黄色化合物的结构简式为 。根据“相似相溶”
规律,水是极性分子,因此属于极性分子的溶质易溶解在水中,即在水中溶解度较大的是棕黄色化合物,其结构简式为 。
相关课件
这是一份高中化学人教版 (2019)选择性必修2第二章 分子结构与性质第二节 分子的空间结构教课内容课件ppt,共60页。PPT课件主要包含了红外光谱原理示意图等内容,欢迎下载使用。
人教版 (2019)高中化学选择性必修2课文《分子结构与物质的性质》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。
人教版 (2019)高中化学必修 第二册课文《乙烯与有机高分子材料》,完整版PPT课件免费下载,优秀PPT背景图搭配,精美的免费ppt模板。轻松备课,欢迎免费下载使用。










