





鲁科版 (2019)第2节 原子结构与元素周期表说课ppt课件
展开
这是一份鲁科版 (2019)第2节 原子结构与元素周期表说课ppt课件,共51页。PPT课件主要包含了随堂演练知识落实,课时对点练,等电子原理,内容索引,价电子对,三键三键,三键双键,双键双键,双键单键,单键单键等内容,欢迎下载使用。
理解价电子对互斥理论和等电子原理,能根据有关理论判断简单分子或离子的空间结构。
一、价电子对互斥(VSEPR)理论
1.基本观点分子中的中心原子的 —— 由于相互 作用,处于不同的空间取向且尽可能趋向于彼此远离。
成键电子对(bp)和孤电子对(lp)
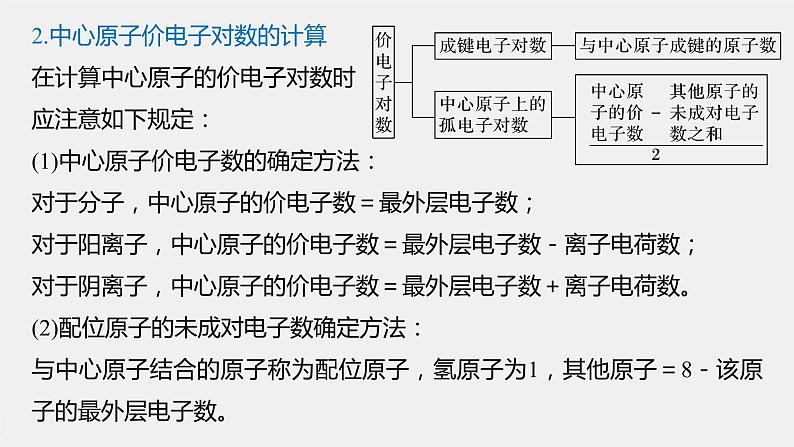
2.中心原子价电子对数的计算在计算中心原子的价电子对数时应注意如下规定:(1)中心原子价电子数的确定方法:对于分子,中心原子的价电子数=最外层电子数;对于阳离子,中心原子的价电子数=最外层电子数-离子电荷数;对于阴离子,中心原子的价电子数=最外层电子数+离子电荷数。(2)配位原子的未成对电子数确定方法:与中心原子结合的原子称为配位原子,氢原子为1,其他原子=8-该原子的最外层电子数。
3.电子对之间的相互排斥作用大小的一般规律(1)成键电子对之间斥力由大到小顺序: > > > > 。(2)含孤电子对的斥力由大到小顺序: >__________ > 。
成键电子对—成键电子对
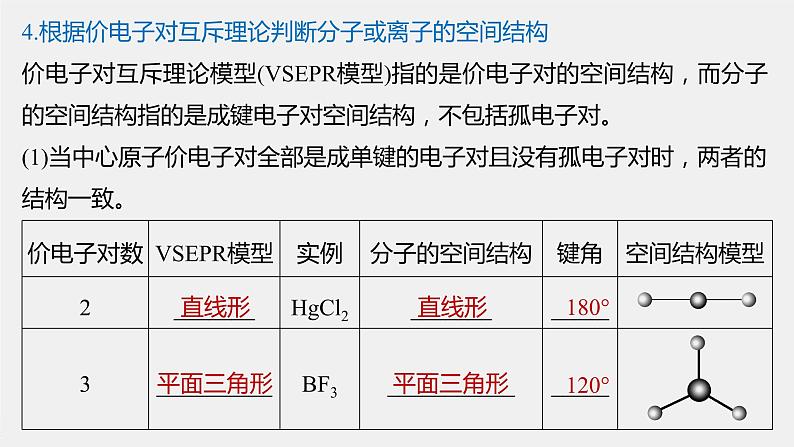
4.根据价电子对互斥理论判断分子或离子的空间结构价电子对互斥理论模型(VSEPR模型)指的是价电子对的空间结构,而分子的空间结构指的是成键电子对空间结构,不包括孤电子对。(1)当中心原子价电子对全部是成单键的电子对且没有孤电子对时,两者的结构一致。
(2)当中心原子有孤电子对时,两者的结构不一致。例如:①乙醇分子中,羟基上的氧原子价电子对数为 ,故价电子对空间结构为 ,但氧原子上有 对孤电子对,因此C—O—H呈 。②NH3分子中,N原子价电子对数为 ,故价电子对空间结构为 ,但N原子上有 对孤电子对,因此NH3分子空间结构为 。
(1)孤电子对的空间排斥力大于σ键电子对的排斥力( )(2)所有的三原子分子都是直线形结构( )(3)VSEPR模型和分子的空间结构一定是一致的( )(4)SO2与CO2分子的组成相似,故它们的空间结构相同( )
1.分析下列微粒中心原子的杂化轨道类型和空间结构:
2.(1)NH3与CH4 分子中心原子杂化方式相同,均为 杂化,但NH3键角小于CH4键角,原因是___________________________________________ 。(2)SnBr2分子中Sn—Br键的键角 120°(填“”或“=”)。
NH3分子中N有一对孤电子对,对成键电子对的斥
力作用大,使得NH3分子键角减小
推断ABn型分子中心原子杂化方式和分子空间结构的一般步骤(1)确定中心原子的价电子对数(2)确定中心原子的杂化方式价电子对数与中心原子杂化方式的关系如下表:
(3)确定分子的空间结构根据分子中成键电子对数和孤电子对数,可以确定分子的空间结构,如下表:
1.基本观点:指 相同、 相等的分子或离子具有相同的空间结构和相同的化学键类型等结构特征。2.等电子体:满足等电子原理的分子或离子互称为 。3.应用:(1)判断一些简单分子或离子的空间结构。(2)针对某物质寻找等电子体。
1.等电子体的结构相似、物理性质相似,下列各对粒子中,空间结构相似的是A.SO2与O3 B.CO2与NO2C.CS2与NO2 D.PCl3与BF3
解析 A项中SO2与O3 互为等电子体,故结构相似。
2.根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。(1)仅由第2周期元素组成的共价分子中,互为等电子体的是_____和____;_____和______。
解析 仅由第2周期元素组成的共价分子中,即C、N、O、F组成的共价分子,如N2与CO价电子总数均为10,CO2与N2O价电子总数均为16个电子。
(1)同主族替换法同主族元素最外层电子数相等,故可将粒子中一个或几个原子换成同主族元素原子,如O3与SO2、CO2与CS2互为等电子体。(2)左右移位法①将粒子中的两个原子换成原子序数分别增加n和减少n(n=1,2等)的原子,如N2与CO、 和CNO-互为等电子体。②将粒子中的一个或几个原子换成原子序数增加(或减少)n的元素带n个单位电荷的阳离子(或阴离子),如 互为等电子体。(3)叠加法互为等电子体的微粒分别再增加一个相同的原子或同主族元素的原子,如N2O与CO2互为等电子体。
1.下列各组微粒属于等电子体的是A.12CO2和14CO B.H2O和NH3C.NO+和CN- D.NO和CO
解析 根据等电子体的条件:①原子总数相同,②最外层电子数之和相等判断,NO+和CN-属于等电子体。
2.甲酸分子(HCOOH)中碳原子的价电子对数为A.1 B.2 C.3 D.4
解析 该有机物中碳原子不存在孤电子对,价电子对数=σ键数,故选C。
3.(2019·合肥高二检测)下列各组分子中所有原子都可能处于同一平面的是A.CH4、CS2、BF3B.CO2、H2O、NH3C.C2H4、C2H2、C6H6D.CCl4、BeCl2、PH3
解析 题中的CH4和CCl4为正四面体形分子,NH3和PH3为三角锥形分子,这几种分子的所有原子不可能都在同一平面上。CS2、CO2、C2H2和BeCl2为直线形分子,C2H4为平面形分子,C6H6为平面正六边形分子,这些分子都是平面形结构。
4.用价电子对互斥理论判断SO3的空间结构为A.正四面体形 B.V形C.三角锥形 D.平面三角形
解析 的价电子对数为4,且含有一对孤电子对,所以其价电子对互斥模型为四面体形,而 的空间结构为三角锥形,A项错误; 的价电子对数为4,不含孤电子对,所以其价电子对互斥模型与其空间结构一致,B项正确; 的价电子对数为3,其中含有一对孤电子对,其价电子对互斥模型与其空间结构不一致,C项错误; 的价电子对数为4,也含有一对孤电子对,其价电子对互斥模型与其空间结构不一致,D项错误。
5.下列离子的价电子对互斥模型与其空间结构一致的是
6.请解答下列各题:(1)写出与H2O分子互为等电子体的两种微粒的化学式:_____、______。
(2)写出一种与 互为等电子体的微粒的化学式:_________________________。
解析 甲醛分子在由于C==O与C—H之间的排斥作用大于2个C—H键之间的排斥作用,所以甲醛分子中C—H键与C—H键之间的夹角小于120°。
(4)用价电子对互斥理论推断甲醛中H—C—H的键角_____(填“>”“<”或“=”)120°。
2.(2019·福建闽侯五校教学联合体联考)下列分子的中心原子含有一对孤电子对的是A.H2O B.BeCl2 C.CH4 D.PCl3
解析 其中NF3、 和H3O+的中心原子N、C、O均采用sp3杂化,但是只形成3个化学键,有1个杂化轨道被孤电子对占据,又由于价电子对相互排斥,所以空间结构为三角锥形;BF3中的B采用sp2杂化,空间结构为平面正三角形,故选C。
3.在以下的分子或离子中,空间结构的几何形状不是三角锥形的是A.NF3 B. C.BF3 D.H3O+
4.(2019·辽宁抚顺六校联合体高二联考)膦(PH3)又称磷化氢,在常温下是一种无色、有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的空间结构是三角锥形。则下列关于PH3的叙述正确的是A.PH3分子中有未成键的孤电子对B.PH3中的P采取sp2杂化C.PH3是一种强氧化剂D.PH3分子中的P—H键间夹角是90°
解析 P最外层有5个电子,形成3个共价键后,PH3分子中有一对孤电子对,A项正确;PH3的结构与NH3相似,P原子采取sp3杂化,B项错误;PH3中的P是-3价,有强还原性,C项错误;PH3的空间结构为三角锥形,P—H键间夹角略小于NH3中N—H键间夹角,D项错误。
5.(2019·河北冀州中学高二月考)用价电子对互斥理论预测PCl3和 的空间结构,结论正确的是A.直线形 三角锥形B.三角锥形 平面三角形C.V形 三角锥形D.直线形 平面三角形
解析 根据价电子对互斥理论知,ABn型分子的中心原子A上没有孤电子对时,若n=3,则分子的空间结构为平面三角形,A错误;若n=2,则分子的空间结构为直线形,B错误;若n=4,则分子的空间结构为正四面体形,C正确,D错误。
6.(2019·昆明高二月考)若ABn型分子的中心原子上没有孤电子对,应用价电子对互斥理论,判断下列说法正确的是A.n=3时,则分子的空间结构为V形B.n=2时,则分子的空间结构为平面三角形C.n=4时,则分子的空间结构为正四面体形D.n=4时,则分子的空间结构为三角锥形
二、不定项选择题7.下列不属于等电子体的是A.N2和CO B.CO2和N2OC.PH3和HCl D.H2S和H2O
解析 A项,N2和CO均为双原子分子,且均有10个价电子,属于等电子体;B项,CO2和N2O均为三原子分子,且均有16个价电子,属于等电子体;C项,PH3和HCl分子中所含原子数不同,不是等电子体;D项,H2S和H2O均为三原子分子,价电子数均为8,属于等电子体。综上所述,C项符合题意。
8.下列几组微粒互为等电子体的是① ②NO+和CN- ③CO2和CS2 ④N2O和CO2 ⑤BF3和SO3A.仅①②③ B.仅④⑤C.仅①③④ D.①②③④⑤
解析 等电子体具有两个明显特征:一是原子总数相等,二是价电子总数相等。①~⑤组微粒的原子总数分别相等,其中① 的价电子总数均为26,②NO+和CN-的价电子总数均为10,③CO2和CS2的价电子总数均为16,④N2O和CO2的价电子总数均为16,⑤BF3和SO3的价电子总数均为24,故D项正确。
9.(2019·湖北襄阳五中检测)通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是A.CH4和 互为等电子体,键角均为60°B. 互为等电子体,空间结构相同C.H3O+和PCl3互为等电子体,均为三角锥形结构D.B3N3H6和苯互为等电子体,B3N3H6分子中存在“肩并肩”式重叠的轨道
解析 CH4和 互为等电子体,都是正四面体结构,键角均为109°28′,A项不正确; 互为等电子体,均为平面正三角形结构,B项正确;H3O+和PCl3的价电子总数不相等,不互为等电子体,C项不正确;B3N3H6和苯互为等电子体,B3N3H6的空间结构与苯相似,分子中存在“肩并肩”式重叠的轨道,D项正确。
三、非选择题10.(2019·河北衡水中学高二月考)(1)在BF3分子中,F—B—F的键角是_____,硼原子的杂化轨道类型为____,BF3和过量NaF作用可生成NaBF4, 的空间结构为___________。
解析 因为BF3的空间结构为平面三角形,所以F—B—F的键角为120°。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的空间结构是________;N2H4分子中氮原子轨道的杂化类型是____。
(3)H+可与H2O形成H3O+,H3O+中氧原子采用____杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_____________________________________________________________________。
解析 H3O+中氧原子采用sp3杂化。
(4) 的空间结构是__________,其中硫原子的杂化轨道类型是____。
H2O中氧原子有2对孤电子
对,H3O+中氧原子只有1对孤电子对,排斥力较小
11.(1)S与O可形成 。① 的空间结构为____________。②写出一种与 互为等电子体的分子的化学式:___________________________。
CCl4(或SiCl4,合理答
(2)已知CO2为直线形结构,SO3为平面正三角形结构,NF3为三角锥形结构,请推测COS、 、PCl3的空间结构:_______________________________________________________________。
平面正三角形结构;PCl3为三角锥形结构
解析 C、N、O属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大呈增大趋势,但第ⅤA族元素的第一电离能大于第ⅥA族元素的第一电离能,故第一电离能大小顺序是N>O>C,同周期元素自左而右电负性增大,故电负性:O>N>C,氮原子的核电荷数为7,核外电子排布式为1s22s22p3,其最外层电子排布式是2s22p3。
12.氰化钾是一种剧毒物质,贮存和使用时必须注意安全。已知:KCN+H2O2===KOCN+H2O。回答下列问题:(1)OCN-中所含三种元素的第一电离能从大到小的顺序为________(用元素符号表示,下同),电负性从大到小的顺序为________,基态氮原子最外层电子排布式为_______。
解析 OCN-含有3个原子,价电子总数为6+4+5+1=16,故其等电子体可以是CO2、N2O等。
(2)与OCN-互为等电子体的分子为______________(任举一例)。
13.(2019·安徽蚌埠二中高二期中)短周期元素D、E、X、Y、Z原子序数逐渐增大。它们的最简单氢化物分子的空间结构依次是正四面体形、三角锥形、正四面体形、V形、直线形。回答下列问题:(1)Y的最高价氧化物的化学式为____;Z的核外电子排布式是_______________________。(2)D的最高价氧化物与E的一种氧化物为等电子体,写出该E的氧化物的化学式:_____。(3)D和Y形成的化合物,其分子的空间结构为______,D原子的轨道杂化方式是_______。X与Z构成的分子是______(填化学式)。
1s22s22p63s23p5
或[Ne]3s23p5
解析 短周期元素形成的最简单氢化物有CH4、NH3、H2O、HF、SiH4、PH3、H2S、HCl等,空间结构呈正四面体的有CH4、SiH4,呈三角锥形的有NH3、PH3,呈V形的有H2O、H2S。由D、E、X、Y、Z原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体形、三角锥形、正四面体形、V形、直线形知,D、E、X、Y、Z对应的元素分别是碳、氮、硅、硫、氯,据此解答。
14.如图是甲醛分子的模型,根据图示和所学化学知识回答下列问题:
(1)甲醛分子中碳原子的杂化方式是________,作出该判断的主要理由是_______________________________。
甲醛分子的空间结构为平面三角形
解析 原子的杂化轨道类型不同,分子的空间结构也不同。由图可知,甲醛分子为平面三角形,所以甲醛分子中的碳原子采取sp2杂化。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是_____(填序号)。①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
解析 醛类分子中都含有C==O键,所以甲醛分子中的碳氧键是双键。一般来说,双键是σ键和π键的组合。
(3)甲醛分子中C—H键与C—H键间的夹角______(填“=”“>”或“
相关课件
这是一份高中化学人教版 (2019)选择性必修2第二节 分子的空间结构教课ppt课件,共44页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构多媒体教学ppt课件,共16页。PPT课件主要包含了价层互斥理论,价层电子对数,孤电子对的计算,½a-xb,剖析内容,排斥力最小,平面三角形,正四面体,应用反馈,空间构型等内容,欢迎下载使用。
这是一份高中化学专题4 分子空间结构与物质性质第一单元 分子的空间结构课前预习ppt课件,共51页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。










