




所属成套资源:人教版九年级化学全册课件 汇编
初中化学人教版九年级下册课题 2 金属的化学性质课文内容课件ppt
展开
这是一份初中化学人教版九年级下册课题 2 金属的化学性质课文内容课件ppt,共59页。
1.在生产和生活中,使用最多的金属材料是( )A.铁 B.铝 C.铜 D.锌2.写化学式:氧化铝______;盐酸______;硫酸________;硫酸亚铁________;硫酸铝__________。
为什么先有青铜时代后有铁器时代
金属的应用不仅与物理性质相关,还与化学性质有密切关系。
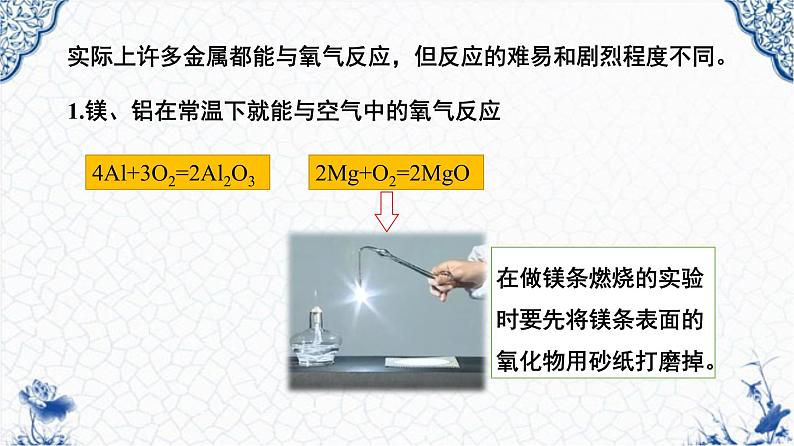
1.镁、铝在常温下就能与空气中的氧气反应
2Mg+O2=2MgO
实际上许多金属都能与氧气反应,但反应的难易和剧烈程度不同。
4Al+3O2=2Al2O3
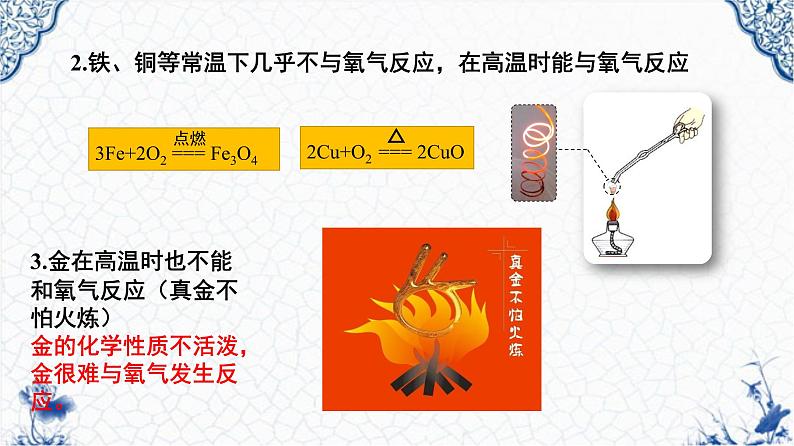
2.铁、铜等常温下几乎不与氧气反应,在高温时能与氧气反应
3.金在高温时也不能和氧气反应(真金不怕火炼)金的化学性质不活泼,金很难与氧气发生反应。
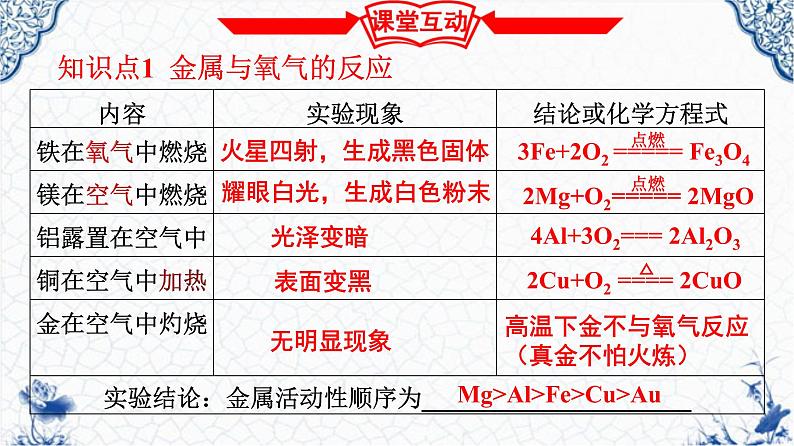
火星四射,生成黑色固体
耀眼白光,生成白色粉末
4Al+3O2=== 2Al2O3
高温下金不与氧气反应(真金不怕火炼)
Mg>Al>Fe>Cu>Au
知识点1 金属与氧气的反应
镁、铝与氧气反应剧烈,铁、铜常温下几乎不与氧气反应,但在高温时能与氧气反应。金即使在高温时也不与氧气反应。
金属活动性Mg>Al>Fe>Cu>Au
判断金属活动性的方法之一: 根据金属与氧气反应的难易程度或者反应现象的剧烈程度判断
铝在常温下就能与空气中的氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
用钢丝球擦洗铝制餐具时,会刷掉铝制品表面致密的氧化铝薄膜,对铝制品有损坏,缩短铝制品的寿命。
[思考]铝制品为什么有较好的抗腐蚀性能?_____________________________________________________________________________________________。【课堂练习1】1.为什么不宜用钢刷、沙等来擦洗铝制品?_______________________________。
铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化
会刷掉表面的致密氧化铝薄膜
2.黄金是一种贵重金属,下列事实不能解释金的化学性质稳定的是( )A.自然界黄金能以单质形式存在B.“真金不怕火炼”C.黄金质地比较软D.黄金在潮湿的空气中不会锈蚀
二、金属与盐酸、稀硫酸的反应
实验探究:金属与盐酸的反应
Help! help !
我得意的笑,又得意的笑…
镁、锌、铁、铜的金属活动性由强到弱
镁、锌、铁与盐酸反应的剧烈程度是不同的,镁最剧烈、锌较剧烈、铁较慢。铜不反应
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
金属与稀硫酸的反应跟与稀盐酸的反应相似。
知识点2 金属与盐酸、稀硫酸的反应【课堂活动2】完成课本第10页的探究实验并写下表:
快速产生气泡,放热,镁很快溶解
Mg+2HCl=== MgCl2+H2↑
Mg+H2SO4=== MgSO4+H2↑
产生气泡,锌逐渐溶解
Zn+2HCl==ZnCl2+H2↑
Zn+H2SO4== ZnSO4+H2↑
缓慢产生气泡,溶液逐渐变浅绿色
Fe+2HCl=== FeCl2+H2↑
Fe+H2SO4=== FeSO4+H2↑
Mg>Zn>Fe > Cu
判断金属活动性的方法:金属是否与酸反应及反应的剧烈程度判断金属的活动性强弱
由上述探究可以得出,镁、锌、铁的金属活动性比铜强,它们能置换出盐酸或稀硫酸中的氢。
较活泼,能与盐酸或稀硫酸反应放出H2。
不活泼,不能与盐酸或稀硫酸反应放出H2。
金的活动性比铜还弱,所以不会与盐酸发生化学反应;而假黄金中含有锌,它会与盐酸发生化学反应,放出气体。
交流讨论:市售的假黄金的主要成分是黄铜(即铜锌合金),现在你知道为什么可用稀盐酸浸泡的方法来鉴别真伪了吧?
交流讨论:观察这些反应,它们有什么共同点?
置换反应:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
A+B+…=AB… (化合反应)AB…= A+B+… (分解反应)A+BC=AC+B (置换反应)
判断 1、反应前后均为两种物质方法 2、反应前后均为一种单质和一种化合物
知识点3 置换反应【课堂活动3】(1)根据金属与盐酸、稀硫酸的反应规律,写出铝与盐酸、稀硫酸反应的化学方程式:__________________________________、___________________________________。
2Al+6HCl=== 2AlCl3+3H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑
(2)根据金属与盐酸、稀硫酸反应的化学方程式,根据反应物、生成物的类别(“单质”或“化合物”)找出它们有哪些共同点:____________________________________。[归纳]置换反应:___________________________________________________。
反应物、生成物都属于单质和化合物
单质与一种化合物反应,生成另一种单质和另一种化合物
【课堂练习2】1.将黄铜(铜锌合金)和足量的稀硫酸充分反应后,总会有一些残渣剩余,残渣的成分主要是( )A.硫酸铜 B.硫酸锌C.铜 D.锌
2.下列反应属于置换反应的是( ) A.CH4+2O2 ==== CO2+2H2O B.2H2O2 ==== 2H2O+O2↑C.H2+CuO ==== Cu+H2OD.CO+CuO ==== Cu+CO2
3.下列物质不能由金属与盐酸或稀硫酸反应直接生成的是( )A.ZnCl2 B.CuSO4C.FeCl2 D.Al2(SO4)3
4.社会上一些不法分子以铜锌合金(金黄色,俗称黄铜)假冒黄金进行诈骗活动。为了鉴别黄铜和黄金,下列方法可行的是( )A.观察颜色 B.称取质量C.用磁铁吸引 D.插入稀盐酸中
1.下列反应不属于置换反应的是( )A.碳与氧化铜反应得到铜和二氧化碳B.镁与稀盐酸反应得到氢气C.一氧化碳和氧化铁反应得到铁和二氧化碳D.铝与氧化铁高温反应得到铁和氧化铝
2.下列物质中,不能用金属跟稀酸反应直接制得的是( )A.硫酸锌 B.氯化镁C.硫酸铁 D.氯化铝3.下列金属和酸能反应并放出氢气的是( )A.Fe和浓硫酸 B.铜和稀盐酸C.锌和稀硝酸 D.铝和稀硫酸
4.生铁(铁、碳的合金)与足量的稀盐酸充分反应后,剩余残渣的主要成分是( )A.铁 B.氯化亚铁 C.碳 D.氯化铁
5.金属R与HCl溶液反应的化学方程式为R+2HCl === RCl2+H2↑,则下列说法错误的是( )A.该反应是置换反应 B.金属R可能是铝C.RCl2中R的化合价为+2D.该反应前后R的化合价发生了改变
金属与盐酸、硫酸的反应
1.金属与酸反应需要注意的问题(1)铁与盐酸和稀硫酸反应,生成的是亚铁的化合物(FeCl2和FeSO4),这种物质在溶液中显浅绿色。利用置换反应不能得到+3价铁的化合物[FeCl3、Fe2(SO4)3]。(2)酸是盐酸、稀硫酸,不能选择浓硫酸和硝酸。(3)一般说来,金属越活泼,同条件下,反应速率越快,同等质量的金属,消耗时间越短。
2.易错点(1)铝比铁耐腐蚀,是因为铝会生成致密的氧化铝保护膜,阻止内部的铝继续氧化。(2)铁与盐酸和稀硫酸反应,得到氯化亚铁和硫酸亚铁,在置换反应中“单质铁变亚铁”。
1反应快慢程度:越靠前的越快,相同时间里生成H2的速度越快。
Mg > Zn > Fe
金属与酸反应的图像问题一、根据金属活动性顺序判断金属跟酸反应快慢
将Mg 、 Zn、 Fe三种等质量金属投入到相同溶质质量分数且足量的盐酸中。
2.生成氢气的质量:Mg > Fe > Zn
3.活动性最弱的金属是 4.反应不再发生时,最先用完的一种物质是
计算:(相同质量)m克镁、铝、锌、铁,分别与足量的稀盐酸反应,产生氢气的质量分别是多少? 并按照由大到小的顺序排列?(相对原子质量 镁:24 铝:27 铁:56 锌:65)
二、等质量金属跟足量(过量)的酸反应生成H2质量多少比较
等质量的不同金属与足量的酸反应产生氢气的质量: Al > Mg > Fe > Zn
Mg +2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
Zn +2HCl=ZnCl2 +H2↑
Fe +2HCl=FeCl2 +H2↑
等质量的Mg、Al、Fe、Zn四种金属分别与稀盐酸(稀硫酸)充分反应反应快慢程度:生成氢气的质量:
Mg >Al> Zn > Fe
Al>Mg > Fe > Zn
产生氢气越多,纵坐标越高。
金属的活动性越强,横坐标越小.
(1).等质量的Mg、Al、Fe、Zn四种金属分别与稀盐酸(稀硫酸)充分反应,画出横坐标为反应时间纵坐标为氢气质量的坐标图
Mg Al Zn Fe
. . . .
AlMg Fe Zn
(2)向等质量的Mg、Al、Zn、Fe中分别滴加等浓度的稀硫酸至过量,Mg产生的氢气质量的图像如图所示,请在图中画出Al、Zn、Fe的图像。
Mg +H2SO4=MgSO4 +H2↑ 2Al+3H2SO4=Al2(SO4 )3+3H2↑Fe +H2SO4=FeSO4 +H2↑ Zn +H2SO4=ZnSO4 +H2↑
三、过量的金属与等量的酸反应(等质量的氢气) 若制取n克氢气,所需镁锌铁铝四种金属的质量各为多少?
制取等质量的氢气消耗金属的质量
*制取1克氢气消耗金属的质量= ———————-
相对原子质量金属化合价绝对值
制取1克氢气消耗金属的质量Mg:12g Al:9g Fe :28g Zn: 32.5g
产生等质量H2,消耗金属Mg、Al、Fe、Zn的质量
Zn>Fe > Mg> Al
例1:Mg、Al、Fe、Zn四种金属分别与稀盐酸(稀硫酸)充分反应制取等质量氢气,画出横坐标为金属质量纵坐标为氢气质量的坐标图
Al Mg Fe Zn
. . . .
练习:1向等质量的Al、Fe(均已打磨)中分别加入等质量等浓度且过量的稀硫酸,在下图中分别画出两者产生氢气的质量随时间变化的图像
2.室温下,等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是
3、向等质量的Mg、Al、Zn、Fe中加入等质量等浓度且过量的稀硫酸,产生氢气的质量随时间变化的曲线是( )
4.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示。根据图中所提供的信息,得出的结论正确的是 ( )(已知:A、B、C在生成物中均为+2价)A.放出H2的质量是A>B>CB.金属活动性顺序是A>B>CC.反应速率最大的是AD.相对原子质量是C>B>A
5、相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。
1.等质量的铝,镁,铁,锌四种金属与过量的盐酸反应产生气体最多的是( )
A.镁 B.铁 C. 铝 D. 锌
2. 与足量的酸反应产生等质量的氢气,则消耗Al、Mg、Fe、Zn 质量最多的是( )
A. Mg B. Zn C. Fe D. Al
3 将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是( )A.反应结束后镁一定有剩余B.反应消耗盐酸的总质量一定相等C.O~t1时段,产生氢气的质量镁比铁大D.O~t2时段,参加反应的镁的质量与铁相等
4.等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,下列叙述正确的是( ) A. 产生H2的速率N>M B. 生成H2的质量M<N C. 相对原子质量较大的是N D. M、N两种金属中较活泼的是N
5.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示,根据图中所提供的信息,得出的结论正确的是( ) A. 放出的H2的质量是A>B>C B. 金属活动性顺序A>B>C C. 相对原子质量是A>B>C D. 反应速率最大的是A
2、等质量的金属A、B与相同质量的稀硫酸反应,在反应中A、B均显+2价,产生氢气的质量随时间变化的情况如右图。则: ⑴金属A、B的活动性:______ ⑵金属A、B的相对原子质量_____。 ⑶对于曲线A表示的反应,物质_______ 有剩余。 ⑷请你写出符合此图像的两种金属:A:_____B:______,并分别写出它们与稀硫酸反应的方程式。
Fe +H2SO4=FeSO4 +H2↑Zn +H2SO4=ZnSO4 +H2↑
总结:等质量的Mg、Al、Zn、Fe和等质量等浓度且过量的稀硫酸反应,比较生成氢气的质量和速率,完成下表。 注意: 过量, 用完
Al>Mg > Fe > Zn
Mg >Al> Zn> Fe
9等质量且过量的Mg、Al、Zn、Fe和等质量等浓度的稀硫酸反应,产生的氢气质量随时间的变化曲线是( )
Mg +H2SO4=MgSO4 +H2↑ 2Al+3H2SO4=Al2(SO4 )3+3H2↑Fe +H2SO4=FeSO4 +H2↑Zn +H2SO4=ZnSO4 +H2↑
巩固.将质量相等的A、B两块金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系如右图所示(产物中A、B两种元素的化合价相同)。分析右图,可以获得的信息有(任写两条):(1) (2)
② 等质量的A比B放出的H2多
③ B放出H2的速度比A快
⑤时间为t1时,B产生的H2比A多,
⑥A的相对原子质量小于B的相对原子质量。
相关课件
这是一份初中化学人教版九年级下册课题 2 金属的化学性质图文ppt课件,共19页。PPT课件主要包含了订正作业,金属于氧气的反应,不相同,MgAl,FeCu,无变化,反应的剧烈程度如何,氢气H2,铜Cu,化合物等内容,欢迎下载使用。
这是一份化学九年级下册课题 2 金属的化学性质备课ppt课件,共28页。PPT课件主要包含了ZnCl2+Fe等内容,欢迎下载使用。
这是一份人教版九年级下册第八单元 金属和金属材料课题 2 金属的化学性质课文配套课件ppt,共60页。











