







高中化学人教版 (2019)选择性必修1第四节 化学反应的调控完美版ppt课件
展开思考:假如你是一个化工厂的老板对工业生产你主要应考虑哪些问题?
1、经济效益2、社会效益
单位时间里提高合成氨的产量
(从化学反应的速率考虑)
提高平衡混合物中氨的含量
(从化学平衡的移动考虑)
从生产成本、动力、材料、设备等对上述理论探讨进一步论证,以得出合理的结论。
反应物表面积、反应物浓度、温度、能引起气体反应物浓度改变的压强、催化剂
2、影响化学平衡移动的因素有哪些?
勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
1、影响化学反应速率的因素有哪些
合成氨反应:N2(g)+3H2(g)⇌2NH3(g)已知298 K时:ΔH=-92.4 kJ·ml-1, ΔS=-198.2 J·ml-1·K-1
(1)可逆性:反应为可逆反应。(2)体积变化:正反应是气体体积缩小的反应。(3)焓变:ΔH<0,熵变:ΔS<0。(4)自发性:常温(298 K)下,ΔH-TΔS<0,能自发进行
工业合成氨时主要考虑的因素?
即提高平衡混合物里氨的含量——化学平衡问题
即提高单位时间里氨的产量——化学反应速率问题
降低成本,提高原料利用率。
保护环境,对设备的要求。
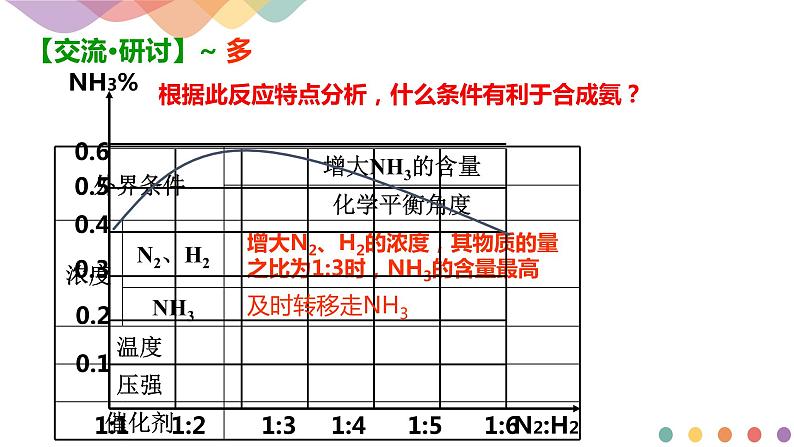
根据此反应特点分析,什么条件有利于合成氨?
增大N2、H2的浓度,其物质的量之比为1:3时,NH3的含量最高
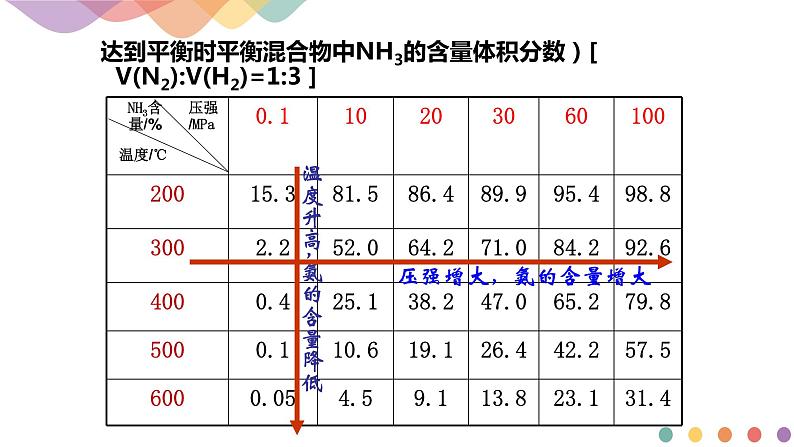
达到平衡时平衡混合物中NH3的含量体积分数)[ V(N2):V(H2)=1:3 ]
根据此反应特点分析,什么条件有利于提高合成氨的速率?
增大N2、H2的浓度,提高氢气压强更有利于提高反应速率,其物质的量之比应<1:3
合成氨的适宜条件的选择
合成氨厂一般采用的压强为10 MPa~30 Mpa。
【思考1】合成氨时压强越大越好,为何不采用比30 MPa更大的压强?
提示:压强越大,对材料的强度和设备的制造要求也越高,需要的动力也越大,这会加大生产投资,可能降低综合经济效益。
压强的选择—成本与效益的博弈
一般采用的温度为400~500 ℃。
【思考2】合成氨采用低温时可提高转化率,但为何未采用更低的温度?
温度的选择—快与少、慢与多的权衡
提示:温度太低,反应速率太小,达到平衡所需的时间变长,不经济。升高温度,转化率降低,另外,合成氨所需的催化剂铁触媒的活性在500 ℃左右活性最大。
工业上合成氨一般采用400~500 ℃的温度,其原因是 ( )①适当提高氨的合成速率 ②提高H2的转化率 ③提高氨的产率 ④催化剂在500 ℃左右活性最大A.只有① B.只有①②C.②③④ D.只有①④
目前,合成氨工业中普遍使用的是以铁为主体的多成分催化剂,又称铁触媒。 铁触媒在500℃左右时的活性最大,这也是合成氨一般选择400~500℃进行的重要原因。 另外,为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化。
使用催化剂可使合成氨反应的速率提高上万亿倍
采取迅速冷却的方法,使气态氨变成液氨后及时从平衡混合物中分离出去,以促使化学平衡向生成NH3的方向移动。此外,如果让N2和H2的混合气体只一次通过合成塔发生反应也是很不经济的,应将NH3分离后的原料气循环使用,并及时补充N2和H2,使反应物保持一定的浓度,以利于合成氨反应。
【思考】合成氨工业采用迅速冷却法,使气态氨变为液氨后及时从混合物中分离出去的目的是什么?
提示:使化学平衡向生成氨的方向移动。
利用原料气在合成塔中合成NH3,为提高N2的转化率所采取的措施是( )A.高温 B.高压C.使用催化剂 D.增大N2的浓度
有关合成氨工业的说法中,正确的是( )A.增大H2的浓度,可提高H2的转化率B.由于氨易液化,N2、H2在实际生产中会循环使用,所以总体来说氨的产率很高C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方向移动D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的活性最大
工业上利用某可逆反应生产产品: 一般要使用催化剂:这样可以大大加快化学反应速率,提高生产效率,也提高了经济效益; 选择合适的温度:该温度是催化剂活性最大的温度; 选择合适的压强:既要考虑化学反应速率和化学平衡,还要考虑动力、材料、设备等。
合 成 氨 流 程 简 图
合成氨工业有下列流程:①原料气制备;②氨的合成;③原料气净化和压缩;④氨的分离。其先后顺序为( )A.①②③④ B.①③ ② ④ C.④③②① D.②③④①
NH3是一种重要的工业原料。下列关于合成氨的说法中,不正确的是( )A.工艺涉及催化技术B.工艺涉及高温高压技术C.原料之一的氮气来自空气D.从合成塔出来的气体中,氨的体积分数为100%
1、原料气干燥、净化:除去原料气中的水蒸气及其他气体杂质,防止与催化剂接触时,导致催化剂“中毒”而降低或丧失催化活性
2、压缩机加压:增大压强
3、热交换:合成氨反应为放热反应,反应体系温度逐渐升高,为原料气反应提供热量,故热交换可充分利用能源,提高经济效益。
4、冷却:生成物NH3的液化需较低温度采取迅速冷却的方法,可使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向生成NH3的方向移动。
5、循环使用原料气:因合成氨反应为可逆反应,平衡混合物中含有原料气,将NH3分离后的原料气循环利用,并及时补充N2和H2,使反应物保持一定的浓度,以利于合成氨反应,提高经济效益。
四、影响化学反应进行的两个因素
(一)参加反应的物质组成、结构和性质等本身因素
(二)温度、压强、浓度、催化剂等反应条件
1、定义:就是通过改变反应条件使一个可能发生的反应按照某一方向进行。
2、考虑因素:在实际生产中常常需要结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素,寻找适宜的生产条件。此外,还要根据环境保护及社会效益等方面的规定和要求做出分析,权衡利弊,才能实施生产。
3、控制反应条件的目的(1)促进有利的化学反应:通过控制反应条件,可以加快化学反应速率,提高反应物的转化率,从而促进有利的化学反应进行。(2)抑制有害的化学反应:通过控制反应条件,也可以减缓化学反应速率,减少甚至消除有害物质的产生或控制副反应的发生,从而抑制有害的化学反应继续进行。
4、控制反应条件的基本措施(1)控制化学反应速率的措施:通过改变反应体系的温度、溶液的浓度、气体的压强(或浓度)、固体的表面积以及使用催化剂等途径调控反应速率。(2)提高转化率的措施:通过改变可逆反应体系的温度、溶液的浓度、气体的压强(或浓度)等改变可逆反应的限度,从而提高转化率。
(1)温度越高越利于合成氨反应平衡正向移动。 ( )(2)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。 ( )(3)使用催化剂能提高合成氨反应物的平衡转化率。 ( )(4)充入的N2越多越有利于NH3的合成。( )(5)恒容条件下充入稀有气体有利于NH3的合成。( )(6)工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行。( )
判断正误(正确的打“√”,错误的打“×”)
某工业生产中发生反应:2A(g)+B(g)⇌2M(g) ΔH<0。下列有关该工业生产的说法正确的是( )A.工业上合成M时,一定采用高压条件,因为高压有利于M的生成B.若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高D.工业生产中常采用催化剂,因为生产中使用催化剂可提高M的日产量
高中化学人教版 (2019)选择性必修1第四节 化学反应的调控完美版ppt课件: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002422_t3/?tag_id=26" target="_blank">第四节 化学反应的调控完美版ppt课件</a>,共3页。
化学选择性必修1第四节 化学反应的调控一等奖课件ppt: 这是一份化学选择性必修1第四节 化学反应的调控一等奖课件ppt,文件包含新人教版化学选择性必修一24化学反应的调控课件pptx、新人教版化学选择性必修一24化学反应的调控针对练习含解析docx、新人教版化学选择性必修一24化学反应的调控教案doc等3份课件配套教学资源,其中PPT共16页, 欢迎下载使用。
人教版 (2019)选择性必修1第四节 化学反应的调控精品ppt课件: 这是一份人教版 (2019)选择性必修1第四节 化学反应的调控精品ppt课件,文件包含24化学反应的调控练习解析版docx、24化学反应的调控练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













