








人教版 (2019)选择性必修1第一节 电离平衡优质课件ppt
展开3.1.2 电离平衡常数 (学案)
重点理解弱电离平衡平衡常数。
弱电离平衡平衡常数
六大强酸是_____________________________________________________。
四大强碱是_____________________________________________________。
一、电离平衡常数(K)、电离度(α)
1.电离常数
(1)表示方法
ABA++B- K=________________
弱电解质的电离常数表达式中的c(A+)、c(B-)和c(AB)均为达到电离平衡后各粒子在溶液中的浓度值,并不是直接指溶质的物质的量浓度值,并且在温度一定时,其电离常数就是一个定值。
①一元弱酸、一元弱碱的电离常数。例如:
CH3COOHCH3COO-+H+,K=________________
NH3·H2ONH+OH-,K=________________
②多元弱酸、多元弱碱的电离常数。
多元弱酸的电离是分步进行的,每步都有相应的电离常数,通常用Ka1,Ka2,Ka3等来分别表示。
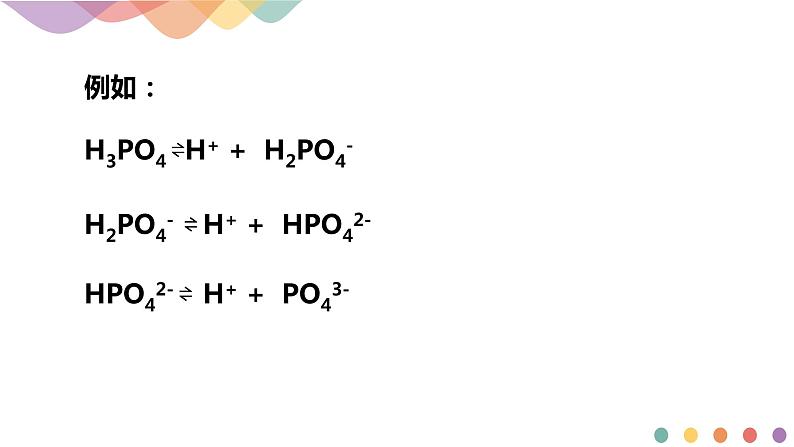
例如:H3PO4H++H2PO4-,Ka1=________________
H2PO4-H++HPO42-,Ka2=________________
HPO42-H++PO43-,Ka3=________________
多元弱酸各步的电离常数大小的比较为Ka1≫Ka2≫Ka3,因此多元弱酸的酸性主要由第一步电离决定。
多元弱碱的电离与多元弱酸的电离情况相类似,但多元弱碱的电离可写成一步。
(2)影响因素
电离常数只与_________有关,_________,K值增大。
(3)电离常数的意义
①表示多元弱酸溶液中离子浓度的关系。
H3PO4分三步电离,第一步最强(Ka1=7.5×10-3),第二步弱(Ka2=6.2×10-8),第三步最弱(Ka3=2.2×10-13),c(H+)>c(H2PO)>c(HPO)>c(PO)>c(OH-)。
H2S分两步电离,第一步强(Ka1=9.1×10-8),第二步弱(Ka2=1.1×10-12),c(H+)>c(HS-)>c(S2-)>c(OH-)
②根据电离常数的大小,可以估算弱电解质电离的程度。例如,在相同条件下,K值越大,弱酸的电离程度越大,酸性越强。在相同条件下,常见弱酸的酸性强弱关系为
H3PO4>HF>CH3COOH>H2CO3>H2S>HClO。
2.电离度
(1)弱电解质的电离度用α表示
则____________________________________
或____________________________________
或____________________________________
【练习】1.已知25℃时,一元弱碱XOH和二元弱酸H2Y的电离平衡常数如下表,下列说法错误的是( )
弱电解质 | XOH | H2Y |
电离常数 | Kb=1.0×10﹣5 | Ka1=1.0×10﹣3 |
Ka2=1.0×10﹣8 |
A.浓度均为0.1mol•L﹣1的XOH与XCl等体积混合,溶液中离子浓度:c(Cl﹣)>c(X+)
B.0.1mol•L﹣1的NaHY溶液中部分微粒浓度大小:c(Na+)>c(HY﹣)>c(Y2﹣)>c(H2Y)
C.用XOH滴定H2Y生成XHY时,选用甲基橙作为指示剂比选用酚酞好
D.浓度均为0.1mol•L﹣1的XOH、H2Y溶液中水电离出的c(H+):前者大于后者
【练习】2.室温时,1mol•L﹣1的HA溶液和1mol•L﹣1的HB溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得曲线如图所示。下列说法中正确的是( )
A.M点溶液中c(A﹣)大于N点溶液中c(B﹣)
B.HA的电离常数约为10﹣6
C.浓度均为0.1mol•L﹣1的NaA和HA混合溶液的pH>7
D.M、P两点的溶液分别用等浓度的NaOH溶液中和,消耗的NaOH溶液体积:P=M
【练习】3.常温下,草酸H2C2O4的Ka1=5.9×10﹣2,Ka2=6.4×10﹣5;碳酸H2CO3的Ka1=4.3×10﹣7,Ka2=5.6×10﹣11.下列说法正确的是( )
A.NaHCO3、NaHC2O4都属于酸式盐且它们对应的水溶液都呈碱性
B.0.010mol•L﹣1NaHCO3溶液中:c(HCO3﹣)>c(H+)>c(H2CO3)>c(CO32﹣)
C.Na2CO3溶液中滴入少量H2C2O4溶液时,反应生成NaHCO3和NaHC2O4
D.10.0mL 0.10mol•L﹣1H2C2O4溶液与等体积NaOH溶液混合,溶液恰好呈中性:n(Na+)+n(H2C2O4)﹣n(C2O42﹣)=0.001mol
【练习】4.25℃时,把0.2mol/L的醋酸加水稀释,那么图中的纵坐标y表示的是( )
A.溶液中OH﹣的物质的量浓度
B.溶液的导电能力
C.溶液中的
D.醋酸的电离程度
【练习】5.常温下,几种弱电解质的电离平衡常数如表所示,向20mL 0.1mo1/L的盐酸溶液中逐滴滴加0.1mo1/L的氨水,溶液的pH变化曲线如图所示。下列说法正确的是( )
弱电解质 | K |
H2CO3 | Ka1=4×10﹣7 Ka2=4×10﹣11 |
NH3•H2O | Kb=1.75×10﹣5 |
CH3COOH | Ka=1.75×10﹣5 |
A.CH3COONH4溶液中c(OH﹣)═c(H+)≠10﹣7mo1/L
B.NH4+和HCO3﹣能发生彻底水解反应
C.曲线上水的电离程度最大的点为b点
D.d点时,c(OH﹣)﹣c(H+)═[c(NH4+)﹣2c(NH3•H2O)]
1.pH=1的两种酸溶液HA、HB各取1mL,分别加水稀释到100mL,其pH与溶液体积的关系如图所示,下列说法正确的是( )
A.HA的酸性比HB的酸性弱
B.若a<3,则HA、HB均为弱酸
C.若a=3,则HA为弱酸,HB为强酸
D.起始时两种酸的物质的量浓度相等
2.常温下,向氨水中加水稀释的过程中,NH3•H2O的电离平衡常数、电离度、溶液导电性的变化正确的是( )
A.增大、增大、减小 B.不变、增大、减小
C.不变、减小、减小 D.减小、减小、增大
3.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。表是某温度下这四种酸在冰醋酸中的电离常数,由表格数据判断以下说法中不正确的是( )
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10﹣5 | 6.3×10﹣9 | 1.6×10﹣9 | 4.2×10﹣10 |
A.相同条件下在冰醋酸中,硝酸是这四种酸中最弱的酸
B.在冰醋酸中,这四种酸都没有完全电离
C.在冰醋酸中,硫酸的电离方程式为H2SO4⇌H++HSO4﹣、HSO4﹣⇌H++SO42﹣
D.电解质的强弱与所处的溶剂无关
4.已知下面三个数据:①7.2×10﹣4、②2.6×10﹣4、③4.9×10﹣10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应NaCN+HNO2═HCN+NaNO2NaCN+HF═HCN+NaF,NaNO2+HF═HNO2+NaF由此可判断下列叙述中不正确的是( )
A.HF的电离常数是①
B.0.1mol/L的HCN溶液中c(H+)=7.0×10﹣6mol/L
C.0.01mol/L HNO2的电离度约为5%
D.反应NaCN+HF═HCN+NaF可以发生
5.25℃时,用0.1 mol•L﹣1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=]如图所示:下列说法错误的是( )
A.用NaOH溶液滴定0.1 mol•L﹣1NaHA溶液可用酚酞作指示剂
B.0.1 mol•L﹣1Na2A溶液中:c(Na+)<c(HA﹣)+2c(A2﹣)
C.0.1 mol•L﹣1NaHA溶液中:c(Na+)>c(HA﹣)>c(A2﹣)>c(H2A)
D.H2A 的K2=1×10﹣7
6.对于常温下0.1mol•L﹣1氨水和0.1mol•L﹣1醋酸,下列说法正确的是( )
A.0.1mol•L﹣1氨水,溶液的pH=13
B.向0.1mol•L﹣1氨水中加入少量水,溶液中增大
C.0.1mol•L﹣1醋酸溶液中:c(H+)=c(CH3COO﹣)
D.向0.1mol•L﹣1醋酸中加入少量水,醋酸电离平衡正向移动
7.已知常温下一水合氨的电离常数Kb=1.8×10﹣5,在等物质的量NH4Cl与NH3•H2O组成的混合液中,下列关系正确的是( )
A.c(NH3•H2O)>c(Cl﹣) B.c(H+)=c(OH﹣)
C.c(NH4+)>c(Cl﹣) D.c(Cl﹣)=c(OH﹣)
【课前复习答案】
【知识点填空答案】;;;;
;;温度;升高温度;
α=×100%;α=×100%;
α=×100%。
【练习答案】ADDBD
【检测反馈答案】BBDCBDC
高中化学人教版 (2019)选择性必修1第一节 电离平衡优秀ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡优秀ppt课件,文件包含312电离平衡常数练习解析版docx、312电离平衡常数练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
人教版 (2019)选择性必修1第一节 电离平衡完美版ppt课件: 这是一份人教版 (2019)选择性必修1第一节 电离平衡完美版ppt课件,文件包含人教版高中化学选择性必修一312《电离平衡常数》课件pptx、人教版高中化学选择性必修一312《电离平衡常数》学案docx等2份课件配套教学资源,其中PPT共43页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡授课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡授课课件ppt,共23页。PPT课件主要包含了情境引入,表示方法,电离平衡常数,强弱电解质的比较,学以致用,随堂巩固等内容,欢迎下载使用。













