




所属成套资源:【新教材】人教版高中化学选择性必修一课件+学案+练习【成套】
- 3.1.1 强电解质和弱电解质 弱电解质的电离平衡-【新教材】人教版(2019)高中化学选择性必修一课件+学案+练习 课件 46 次下载
- 3.1.2 电离平衡常数-【新教材】人教版(2019)高中化学选择性必修一课件+学案+练习 课件 41 次下载
- 3.2.2 酸碱中和滴定-【新教材】人教版(2019)高中化学选择性必修一课件+学案+练习 课件 41 次下载
- 3.3.1 盐类的水解-【新教材】人教版(2019)高中化学选择性必修一课件+学案+练习 课件 44 次下载
- 3.3.2 影响盐类水解的主要因素 盐类水解的应用-【新教材】人教版(2019)高中化学选择性必修一课件+学案+练习 课件 42 次下载
化学选择性必修1第二节 水的电离和溶液的pH优秀ppt课件
展开这是一份化学选择性必修1第二节 水的电离和溶液的pH优秀ppt课件,文件包含321水的电离溶液的酸碱性与pH课件-新教材人教版2019高中化学选择性必修一pptx、321水的电离溶液的酸碱性与pH学案-新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
3.2.1 水的电离 溶液的酸碱性与pH(学案)
1.了解水的电离、离子积常数。
2.了解溶液pH的定义。
3.了解测定溶液pH的方法,能进行pH的简单计算。
1.pH的计算。
pH试纸收到使用方法是_____________________________________________________。
一、水的电离
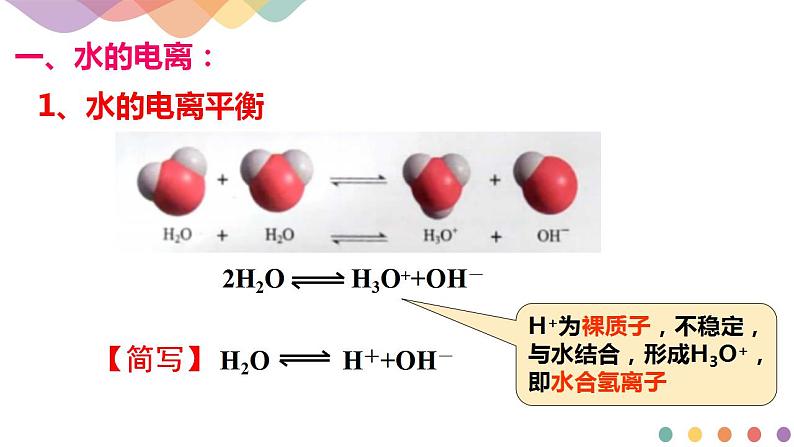
1.水的电离
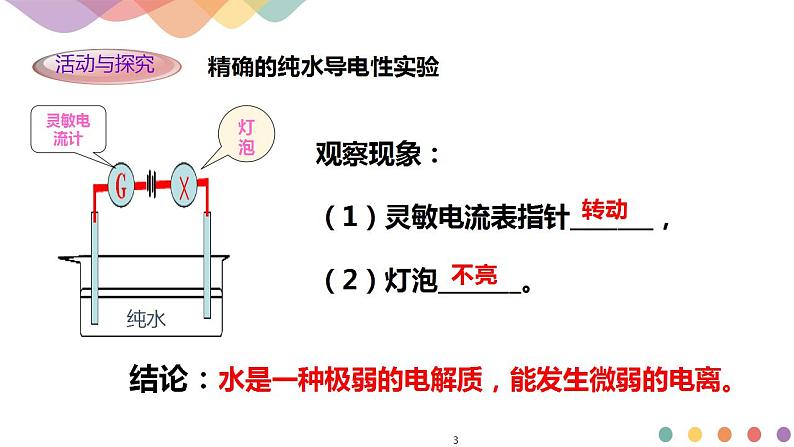
水是一种极弱的电解质,电离方程式为H2O+H2O⇌H3O++OH-,简写为___________________________,水的电离常数K电离=
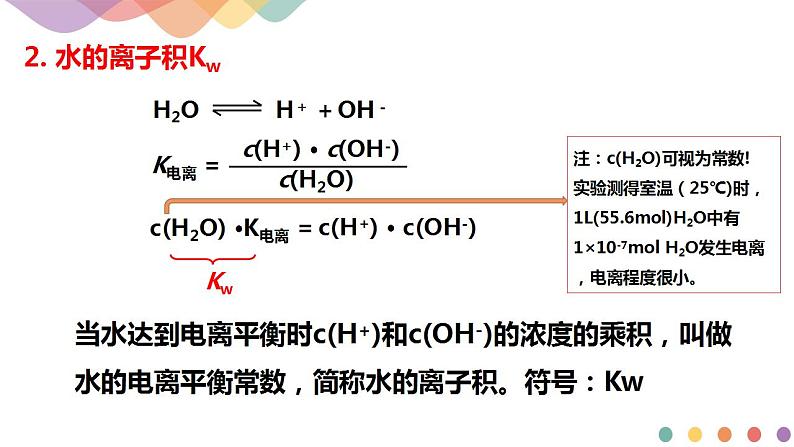
2.水的离子积常数
(1)Kw的推导
水的电离平衡常数K电离=,则c(H+)·c(OH-)=K电离·c(H2O)。从实验可知,在室温时55.6mol纯水中只有1×10-7molH2O电离,电离前后H2O的物质的量几乎不变,因此c(H2O)可视为常数,K电离也为一常数,所以K电离·c(H2O)必然也为常数,用Kw表示,因此有c(H+)·c(OH-)=Kw。
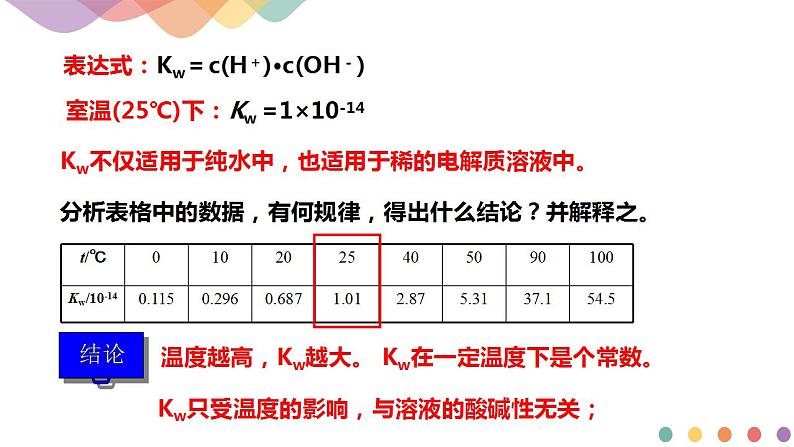
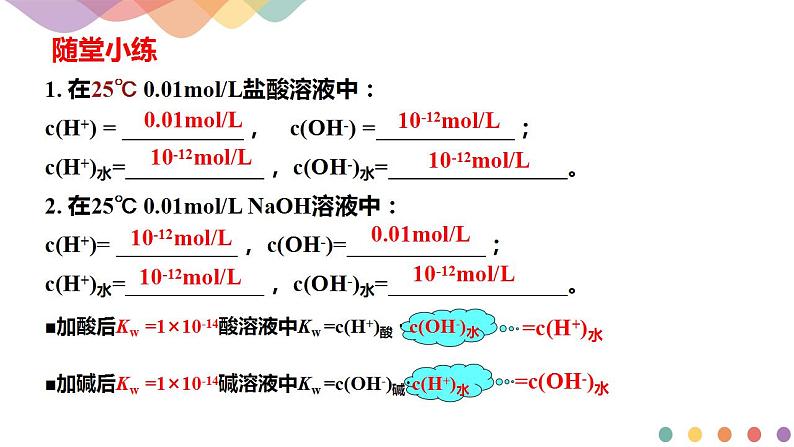
25℃时,c(H+)=c(OH-)=______________mol/L;KW=c(H+)·c(OH-)=______________
(2)Kw的影响因素
水的离子积Kw,只受______________的影响,______________,Kw增大。
(3)Kw的适用范围
Kw不仅适用于纯水,还可适用于______________。
二、溶液的酸碱性和pH
1.溶液的酸碱性
(1)常温下溶液的酸碱性与pH的关系
①pH<7,溶液呈__________;②pH=7,溶液呈__________;③pH>7,溶液呈__________。
(2)溶液的酸碱性与c(H+)、c(OH-)的关系
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
①c(H+)>c(OH-)溶液呈______________;②c(H+)=c(OH-)溶液呈______________;③c(H+)<c(OH-)溶液呈______________。
2.pH
(1)表达式:pH=______________。
(2)意义:pH越大,溶液碱性______________;pH越小,溶液酸性______________。
(3)适用范围:1×10-14mol·L-1≤c(H+)≤1mol·L-1的溶液。
二、稀释过程溶液pH值的变化规律:
1.强酸溶液:稀释10n倍时,pH稀=pH原+n(但始终不能大于或等于7)
2.弱酸溶液:稀释10n倍时,pH稀〈pH原+n(但始终不能大于或等于7)
3.强碱溶液:稀释10n倍时,pH稀=pH原-n(但始终不能小于或等于7)
4.弱碱溶液:稀释10n倍时,pH稀〉pH原-n(但始终不能小于或等于7)
5.不论任何溶液,稀释时pH均是向7靠近(即向中性靠近);任何溶液无限稀释后pH均接近7
6.稀释时,弱酸、弱碱和水解的盐溶液的pH变化得慢,强酸、强碱变化得快。
四、溶液酸、碱性的测定方法
(1)指示剂法
该法只能测其pH的大致范围,常见指示剂变色范围为
指示剂 | 变色范围 | ||
石蕊 | pH<5红色 | 5~8紫色 | >8蓝色 |
酚酞 | pH<8.2无色 | 8.2~10浅红色 | >10红色 |
甲基橙 | pH<3.1红色 | 3.1~4.4橙色 | >4.4黄色 |
(2)pH试纸法
把小片试纸放在表面皿或玻璃片上,用干燥洁净的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸变色后,与标准比色卡对比,即可确定溶液的pH。
【练习】1.下列溶液一定呈中性的是( )
A.使甲基橙试液呈黄色的溶液
B.c(H+)=c(OH﹣)=10﹣6mol/L溶液
C.pH=7的溶液
D.酸与碱恰好完全反应生成正盐的溶液
【练习】2.25℃时,下列溶液中水的电离程度最小的是( )
A.0.01mol/L醋酸溶液 B.0.01mol/L NH4Cl溶液
C.0.01mol/L NaHSO4溶液 D.0.01mol/L NaHCO3溶液
【练习】3.常温下,某溶液中由水电离出来的c(H+)=1.0×10﹣13mol•L﹣1,该溶液可能是( )
①稀盐酸②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
【练习】4.下列操作中,能使电离平衡H2O⇌H++OH﹣正向移动且溶液呈酸性的是( )
A.向水中加入Na2CO3溶液
B.向水中加入NaHSO4溶液
C.向水中加入Al2(SO4)3溶液
D.将水加热到100℃,使水的pH=6
【练习】5.40℃时水的离子积Kw=2.9×10﹣14,则在40℃时,c(H+)=1×10﹣7mo1•L﹣1的溶液( )
A.呈酸性 B.呈碱性 C.呈中性 D.无法判断
【练习】6.图中的4条曲线,能表示人体大量喝水时,胃液pH变化的是( )
A. B.
C. D.
【练习】7.在下列的各种叙述中,正确的是( )
A.在任何条件下,纯水的pH=7
B.在任何条件下,纯水都呈中性
C.在100℃时,纯水的pH>7
D.在100℃时,纯水中c(H+)<10﹣7mol/L
【练习】8.乐山盛产西红柿,常温下某鲜榨西红柿汁的pH=3,则c(H+)为( )
A.3mol/L B.0.003mol/L
C.1×10﹣11mol/L D.1×10﹣3mol/L
【练习】9.常温下,在pH=12的NaOH溶液中,由水电离出的c(OH﹣)为( )
A.1.0×10﹣7mol/L B.1.0×10﹣6mol/L
C.1.0×10﹣3mol/L D.1.0×10﹣12mol/L
【练习】10.如表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积Kw | 1×10﹣14 | a | 1×10﹣12 |
试回答以下问题:
(1)若25<t1<t2,则a_____1×10﹣14(填“>”“<”或“=”)。
(2)25℃时,某Na2SO4溶液中c(SO42﹣)=5×10﹣4mol•L﹣1,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH﹣)=_____。
(3)在t2℃下pH=10的NaOH溶液中,水电离产生的OH﹣浓度c(OH﹣)水=_____。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=_____。
1.下列溶液肯定显酸性的是( )
A.含H+的溶液 B.加酚酞显无色的溶液
C.pH<7的溶液 D.c(H+)>c(OH﹣)的溶液
2.下列物质对水的电离平衡没有影响的是( )
A.NaF B.KI C.KAl(SO4)2 D.NaHSO4
3.25℃时,0.005mol/L Ba(OH)2中H+浓度是( )
A.1×10﹣12mol/L B.1×10﹣13mol/L
C.5×10﹣12mol/L D.5×10﹣13mol/L
4.100℃时,Kw=1×10﹣12,对纯水的叙述正确的是( )
A.pH=6显弱酸性
B.c(H+)=10﹣6 mol/L,溶液为中性
C.Kw是常温时的10﹣2倍
D.常温下,pH=6的溶液为中性
5.pH相同的盐酸和醋酸两种溶液,它们的( )
A.H+的物质的量相同 B.物质的量浓度相同
C.H+的物质的量浓度不同 D.H+的物质的量浓度相同
6.对于溶液的酸碱性,下列说法正确的是( )
A.pH=7的溶液一定呈中性
B.同温时,溶液pH相差3,则c(H+)相差3倍
C.pH=6的HCl加水稀释1000倍后,溶液呈碱性
D.同温时,pH=5的CH3COOH溶液酸性比pH=6的盐酸的酸性强
7.下列说法正确的是( )
A.强电解质溶液的导电能力一定大于弱电解质溶液的导电能力
B.pH=4.5的番茄汁中的c(H+)是pH=6.5的牛奶中的2倍
C.0.1mol•L﹣1CH3COOH溶液与0.1mol•L﹣1盐酸的pH相等
D.CH3COONa溶液中只存在两种分子
8.某可口可乐饮料的pH=3,某西红柿汁饮料的pH=4,则这两种饮料中的c(OH﹣)之比是( )
A.3:4 B.1:10 C.10:1 D.无法确定
9.已知常温下柠檬水的pH是3,纯碱溶液的pH是13,两溶液中的c(H+)浓度之比为( )
A.3:11 B.1:1
C.10﹣3:10﹣13 D.10﹣11:10﹣13
【课前复习答案】把小片试纸放在表面皿或玻璃片上,用干燥洁净的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸变色后,与标准比色卡对比,即可确定溶液的pH。
【知识点填空答案】
H2O⇌H++OH-;10-7;1×10-14;温度;温度升高;电解质水溶液;酸性;中性;碱性;酸性;中性;;碱性;-lgc(H+)
【练习答案】(1-9):BCACBABDD;(10):>;1000:1;10﹣10mol•L﹣1;9:11
【检测反馈答案】DBABDDDBC
相关课件
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优质ppt课件,文件包含第二节水的电离和溶液的酸碱性ppt、实验活动2强酸与强碱的中和滴定mp4等2份课件配套教学资源,其中PPT共58页, 欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH图文ppt课件,共38页。
这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀ppt课件,共23页。PPT课件主要包含了学习目标,第1课时水的电离,认识水的电离,了解水的离子积常数等内容,欢迎下载使用。













