








所属成套资源:【新教材】人教版(2019)高中化学选择性必修一课件+讲义+课时作业【成套】
- 第2章 第2节 第1课时 化学平衡状态 化学平衡常数 【新教材】人教版(2019)高中化学选择性必修1课件+讲义+课时作业 课件 4 次下载
- 第2章 第2节 第2课时 影响化学平衡的因素 【新教材】人教版(2019)高中化学选择性必修1课件+讲义+课时作业 课件 2 次下载
- 第2章 第2节 微专题4 化学平衡图像 【新教材】人教版(2019)高中化学选择性必修1课件+讲义+课时作业 课件 1 次下载
- 第2章 第3节 化学反应的方向 【新教材】人教版(2019)高中化学选择性必修1课件+讲义+课时作业 课件 1 次下载
- 第2章 第4节 化学反应的调控 【新教材】人教版(2019)高中化学选择性必修1课件+讲义+课时作业 课件 1 次下载
高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡公开课作业课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡公开课作业课件ppt,文件包含第2章第2节微专题3化学平衡常数的应用方向课件新教材人教版2019高中化学选择性必修1共21张PPTppt、第2章第2节微专题3化学平衡常数的应用方向讲义新教材人教版2019高中化学选择性必修1doc等2份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
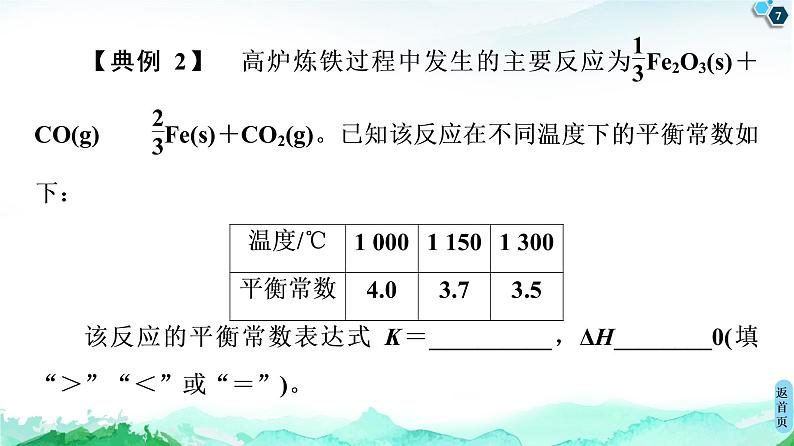
微专题3 化学平衡常数的应用方向[微点突破]1.考查化学平衡常数(K)的计算方法——三段式法三段式法就是依据化学方程式列出各物质的起始量、变化量和平衡量,然后根据已知条件建立代数等式而进行解题的一种方法。这是解答化学平衡计算题的一种“万能方法”,只要已知起始量和转化率就可用平衡模式法解题。对于反应前后气体体积变化的反应,如果已知反应前气体的总物质的量与反应后气体的总物质的量的差值,也可用差量法解题。【典例1】 在1.5 L的密闭容器中通入2 mol N2和3 mol H2,混合气体在一定温度下发生反应。达到平衡时,容器内压强为反应开始时的0.8,则该反应的化学平衡常数约为( )A.0.34 B.0.64C.0.44 D.0.54C [定T、V的情况下,压强之比等于物质的量之比,设N2转化x mol,则 N2(g) + 3H2(g)2NH3(g)起始量/mol 2 3 0转化量/mol x 3x 2x平衡量/mol 2-x 3-3x 2x===,解得x=0.5,则K===≈0.44。]2.考查利用K值变化判断反应的热效应其他条件不变时,若正反应是吸热反应,由于升高(或降低)温度时平衡向正(或逆)反应方向移动,K值增大(或减小);若正反应是放热反应,由于升高(或降低)温度时平衡向逆(或正)反应方向移动,K值减小(或增加);所以温度升高时平衡常数可能增大,也可能减小,但不会不变。【典例2】 高炉炼铁过程中发生的主要反应为Fe2O3(s)+CO(g)Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:温度/℃1 0001 1501 300平衡常数4.03.73.5该反应的平衡常数表达式K=__________,ΔH________0(填“>”“<”或“=”)。[解析] 因Fe和Fe2O3都为固体,不能代入平衡常数的表达式,所以K=,由表中数据知,温度升高,平衡常数减小,说明平衡向左移动,故ΔH<0。[答案] <3.考查可逆反应是否达到平衡状态及反应方向的判断在温度一定的条件下,判断一个化学反应是否达到平衡的根据是:计算出来某一时刻该反应的浓度商Q,将其与平衡常数K进行比较,如果二者相等,则说明反应已达到平衡状态,否则该反应处于非平衡状态。如果反应中有固体或纯液体参加,则它们的浓度不列入平衡常数表达式中,一般步骤为设任一时刻的浓度商(即同样应用K的计算式,但为某一时刻的)为Q,若Q=K,说明反应平衡;Q>K,说明反应向逆向进行;Q<K,说明反应向正向进行。【典例3】 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:t/℃7008008301 0001 200K0.60.91.01.72.6在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应向________(填“正向”或“逆向”)进行。[解析] 判断反应进行的方向时,可根据Q与K的大小关系进行判断,此时刻下,Q===1>0.9,所以反应向逆反应方向进行。[答案] 逆向4.考查利用K计算平衡浓度和反应物的转化率依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。对于反应:aA+bBcC+dD,反应物A的转化率可以表示为α(A)=×100%=×100%=×100%。【典例4】 可逆反应CO(g)+H2O(g)CO2(g)+H2(g)在密闭容器中建立了平衡。当温度为749 K时,K=,问:(1)当CO和H2O的起始浓度为2 mol·L-1时,CO的转化率为________。(2)当CO的起始浓度仍为2 mol·L-1,H2O的起始浓度为6 mol·L-1时,CO的转化率为________。[解析] (1)设CO的转化量为x, CO(g)+H2O(g)CO2(g)+H2(g)起始/(mol·L-1) 2 2 0 0转化/(mol·L-1) x x x x平衡/(mol·L-1) 2-x 2-x x xK===解得:x=1.2,CO的转化率:×100%=60%。(2)设CO的转化量为y, CO(g)+H2O(g)CO2(g)+H2(g)起始/(mol·L-1) 2 6 0 0转化/(mol·L-1) y y y y平衡/(mol·L-1) 2-y 6-y y yK==,解得:y≈1.7CO的转化率:×100%=85%。[答案] (1)60% (2)85%[专题对练]1.某温度下,向容积为2 L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时,测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g)2SO3(g)的平衡常数为( )A.3.2×103 B.1.6×103C.8.0×102 D.4.0×102A [ 2SO2(g)+O2(g)2SO3(g)c(始)/(mol·L-1) 0 0 0.05c(变)/(mol·L-1) 0.01 0.005 0.01c(平)/(mol·L-1) 0.01 0.005 0.04K==3.2×103。]2.一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(s)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断正确的是( )A.该条件下此反应的化学平衡常数约为0.91B.A的平均反应速率为0.3 mol·L-1·s-1C.B的转化率为60%D.若混合气体的密度不再改变时,该反应不一定达到平衡状态A [平衡时,n(C)=0.2 mol·L-1×2 L=0.4 mol,n(D)=0.8 mol,故n(C)∶n(D)=1∶2,所以x=1;平衡时A、B、C的浓度分别为0.9 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,则平衡常数K=≈0.91,A对;v(C)==0.1 mol·L-1·min-1,v(A)=3v(C)=0.3 mol·L-1·min-1,B错;B转化的物质的量n(B)=n(D)=0.4 mol,故B的转化率为α(B)=×100%=40%,C错;该反应前后气体分子数不相等,且气体质量也不相等,因此混合气体的密度不再改变时,该反应一定达到平衡状态,D错。]
相关课件
这是一份2021学年第四章 化学反应与电能第一节 原电池评优课作业课件ppt,文件包含第4章第1节微专题6多角度认识原电池课件新教材人教版2019高中化学选择性必修1共27张PPTppt、第4章第1节微专题6多角度认识原电池讲义新教材人教版2019高中化学选择性必修1doc等2份课件配套教学资源,其中PPT共27页, 欢迎下载使用。
这是一份化学选择性必修1第三节 盐类的水解优秀作业ppt课件,共38页。
这是一份高中化学人教版 (2019)选择性必修1第三节 化学反应的方向优秀作业课件ppt,文件包含第2章第3节化学反应的方向课件新教材人教版2019高中化学选择性必修1共47张PPTppt、8化学反应的方向课时作业新教材人教版2019高中化学选择性必修1doc、第2章第3节化学反应的方向讲义新教材人教版2019高中化学选择性必修1doc等3份课件配套教学资源,其中PPT共47页, 欢迎下载使用。









