

高考一轮复习第2讲:气体摩尔体积
展开知识介绍
◒决定物质体积大小的因素及阿伏加德罗定律
1.决定物质体积大小的因素
(1)物质体积大小的影响因素
(2)粒子数目相同物质的体积关系
2.阿伏加德罗定律
在相同的温度和压强下,任何气体粒子之间的距离可以看成是相等的,这是理解气体体积的理论基础。
(1)阿伏加德罗定律的内容
相同的温度和压强下,粒子数相同的任何气体都具有相同的体积,也可以说,在相同的温度和压强下、相同体积的任何气体都含有相同数目的粒子。
(2)特别提示
①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体;
②同温、同压、同体积、同分子数,共同存在,相互制约,且“三同定一同”。
◓气体摩尔体积
1.气体摩尔体积
2.标准状况下的气体摩尔体积
所以标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例。
3.理解气体摩尔体积应注意的几个问题
(1)适用范围:气态物质,可以是单一气体,也可以是混合气体。
(2)物质在标准状况下为气体,若不是气体或非标准状况均不能用22.4 L·ml-1进行计算。
(3)1 ml气体在非标准状况下的体积,可能是22.4 L,也可能不是22.4 L。
标准状况下,气体摩尔体积的有关计算
①气体的物质的量n=eq \f(V,22.4) ml;
②气体的摩尔质量M=Vm·ρ=22.4ρ g·ml-1;
③气体的分子数N=n·NA=eq \f(V,22.4)·NA;
④气体的质量m=n·M=eq \f(V,22.4)·M g。
◉阿伏加德罗定律的推论及应用
在同温同压(以0 ℃,1.01×105Pa即标准状况为例)下,完成下列问题。
(1)1 ml O2的体积是22.4 L,2 ml H2的体积是44.8 L,eq \f(VO2,VH2)=eq \f(1,2),由此可推知:同温同压下,气体的体积之比等于其物质的量之比。
(2)44.8 L O2的物质的量是2 ml,质量是64 g,44.8 L H2的物质的量是2 ml,质量是4 g,eq \f(mO2,mH2)=eq \f(16,1),由此可推知:同温同压下,同体积的气体的质量之比等于其摩尔质量之比。
(3)1 ml O2的质量是32 g,体积是22.4 L,ρ(O2)=eq \f(m,V)=eq \f(32,22.4) g·L-1(列式不化简,下同)。
1 ml H2的质量是2 g,体积是22.4 L,ρ(H2)=eq \f(m,V)=eq \f(2,22.4) g·L-1。eq \f(ρO2,ρH2)=eq \f(16,1),由此可推知:
①同温同压下,气体的密度之比等于其摩尔质量之比。
②在标准状况下,气体的密度=eq \f(M,22.4) g·L-1。
阿伏加德罗定律的推论
探讨分析
1.设NA为阿伏加德罗常数的值,下列说法不正确的是
A.1 ml CH2CH2分子中含有的共价键数为6NA
B.500 mL 0.5 ml·L-1的NaCl溶液中微粒数大于0.5 NA
C.30 g HCHO与CH3COOH混合物中含C原子数为NA
D. 2.3 g Na与O2完全反应,反应中转移的电子数介于0.1 NA和0.2 NA之间
【答案】D
【解析】本题考查与阿伏加德罗常数相关的计算。1个CH2CH2分子中包含4个单键和1个双键,而1个双键中有2个共价键,故1 ml CH2CH2分子中含有的共价键数为6 NA,A项正确;500 mL 0.5 ml·L-1的NaCl溶液中含有的微粒包括Na+、Cl-、H2O、H+、OH-,故微粒数大于0.5 NA,B项正确;HCHO和CH3COOH的最简式均为CH2O,故30 g HCHO和CH3COOH混合物中含“CH2O”的物质的量为1 ml,含C原子数为NA,C项正确;2.3 g Na与O2完全反应,不论生成Na2O还是Na2O2,转移的电子数均为0.1 NA,D项不正确,故选D。
2.NA是阿伏加德罗常数的值,下列说法正确的是( )
A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.92.0 g甘油(丙三醇)中含有羟基数为1.0NA
D.1.0 ml CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
【答案】B
【解析】A项,16.25gFeCl3的物质的量为0.1ml,但一个胶粒是由多个氢氧化铁分子组成的,故形成的胶粒数目小于0.1NA,错误;B项,标况下22.4LAr为1ml,含有的质子数为18ml,正确;C项,92g甘油为1ml,含有3ml羟基,错误;D项,CH4与Cl2的反应为连续反应,1mlCH4与Cl2在光照下反应生成的CH3Cl小于0.1ml,错误。
【名师点睛】在运用气体摩尔体积求出物质的物质的量时,一定要处于标况下;另外即使是在标况下,还要注意一些物质在标况下是否为气体,如SO3、CH2Cl2、苯、CCl4等;;另外掌握一些特殊物质的结构,比如本题中氩气是单原子分子,甘油是三元醇等。
3.NA是阿伏加德罗常数的值,下列说法正确的是( )
A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.92.0 g甘油(丙三醇)中含有羟基数为1.0NA
D.1.0 ml CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
【答案】B
【解析】A项,16.25gFeCl3的物质的量为0.1ml,但一个胶粒是由多个氢氧化铁分子组成的,故形成的胶粒数目小于0.1NA,错误;B项,标况下22.4LAr为1ml,含有的质子数为18ml,正确;C项,92g甘油为1ml,含有3ml羟基,错误;D项,CH4与Cl2的反应为连续反应,1mlCH4与Cl2在光照下反应生成的CH3Cl小于0.1ml,错误。
【名师点睛】在运用气体摩尔体积求出物质的物质的量时,一定要处于标况下;另外即使是在标况下,还要注意一些物质在标况下是否为气体,如SO3、CH2Cl2、苯、CCl4等;;另外掌握一些特殊物质的结构,比如本题中氩气是单原子分子,甘油是三元醇等。
好题精做
1.下列叙述中正确的是
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 ml任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
2.(云南省泸水市第一中学2017−2018学年高一上学期期中考试)下列说法正确的是
A.1 ml任何气体的体积都是22.4 L
B.1 mlH2的质量是2 g·ml−1,它所占的体积是22.4 L·ml−1
C.标准状况下,1 ml任何物质所占的体积都约为22.4 L
D.标准状况下,1 ml任何气体所占的体积都约为22.4 L
3.下列说法正确的是
A.常温常压下,22.4 L CO2中含有NA个CO2分子
B.标准状况下,22.4 L空气含有NA个单质分子
C.22.4 L Cl2中含有NA个Cl2分子
D.标准状况下,1.12 L O2和1.12 L CO2均含0.1 NA个氧原子
4.(云南省泸水市第一中学2017−2018学年高一上学期期中考试)下列说法正确的是
A.22.4 L任何气体的物质的量均为1 ml
B.非标准状况下,1 ml任何气体不可能占有22.4 L的体积
C.0.3 ml O2、0.3 ml N2和0.4 ml CO2组成的混合气体,在标准状况下的体积约为22.4 L
D.标准状况下,1 ml CO和1 ml CO2的体积比为1∶2
5.同温同压下,等质量的O2和CO2相比较,下列叙述正确的是
A.体积比为8∶1
B.分子个数之比为11∶12
C.密度之比为8∶11
D.原子个数之比为12∶11
6.在标准状况下,与12 g H2的体积相等的N2的
A.质量为12 g B.物质的量为6 ml
C.体积为22.4 L D.物质的量为12 ml
7.设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.14 g乙烯和丙烯混合气体中的氢原子数为2NA
B.1 ml N2与4 ml H2反应生成的NH3分子数为2NA
C.1 ml Fe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
8.(河南省平顶山市、许昌市2017−2018学年高一上学期期中联考)已知6.0 g气体G在标准状况下的体积为4.48 L,则气体G可能是
A.CH4 B.O2 C.NO D.NH3
9.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(NA为阿伏加德罗常数的值)
A. B. QUOTE
C. D. QUOTE
10.(云南省泸水市第一中学2017−2018学年高一上学期期中考试)下列两瓶气体所含分子数一定相等的是
A.同质量的N2和CO2
B.同质量的H2和N2
C.同体积的O2和N2
D.相同物质的量的NO和CO2
11.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
12.以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是
A.现有CO、CO2、O3三种气体,它们分别都含有1 ml O,则三种气体的物质的量之比为3∶2∶1
B.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
13.某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。
实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____ml;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
参考答案
【答案】B
解析:决定气体体积大小的因素是气体数目的多少和气体分子间的距离。一定温度下、压强下,气体体积之比等于其物质之比,故A项错误,B正确,说明某气体的摩尔体积时必须知名所处的状况,C错误,不同的气体,若体积不等,但在不同的特定温度和压强下,他们所含的分子数也可能相等,D项错误。
22.【答案】D
【解析】A、没有已知温度和压强时不能确定气体体积,故A错误;B、质量的单位为g,气体体积的单位为L,故B错误;C、标准状况,1 ml气体所占体积为22.4 L,固体和液体不符合气体摩尔体积的计算,故C错误;D、依据气体摩尔体积概念分析判断,标准状况下,1 ml任何气体所占的体积都约为22.4 L,故D正确。故选D。
3.【答案】D
【解析】A项,常温常压下,22.4 L CO2的物质的量不是1 ml,CO2分子数不是NA个,故说法错误;项,空气是多种成分组成的混合物,不只含有单质,故说法错误;C项,没有指出条件是否为标准状况,故说法错误;D项,标准状况下,1.12 L O2和1.12 L CO2的物质的量均为0.05 ml,含氧原子数均为0.1NA,故说法正确。
4.【答案】C
【解析】A、气体摩尔体积的大小与温度和压强有关,气体摩尔体积不一定都是22.4 L/ml,则22.4 L气体的物质的量不一定为1 ml,故A错误;B、标准状况(0℃、101 kPa)气体摩尔体积为22.4 L/ml,如果在升高温度的同时减小压强,气体摩尔体积也可能为22.4 L/ml,1 ml气体可能占有22.4 L体积,故B错误;C、标况下气体摩尔体积为22.4 L/ml,适用于单一气体或混合气体,而混合气体总共为1 ml,则在标准状况下的体积约为22.4 L,故C正确;D.相同条件下,气体的体积之比等于物质的量之比,则1 ml CO和1 ml CO2的体积比为1∶1,故D错误。故选C。
5.【答案】C
【解析】解等质量的O2和CO2的物质的量之比:n(O2)∶n(CO2)=∶=11∶8,则在同温同压下,其分子数之比为11∶8,B不正确;体积比为11∶8,A不正确;原子个数之比为(11×2)∶(8×3)=11∶12,D不正确;依据公式ρ=,则ρ(O2)∶ρ(CO2)=∶=M(O2)∶M(CO2)=32∶44=8∶11,C正确。
6.【答案】B
【解析】12 g H2的物质的量为=6 ml,标准状况下,V(H2)=n·Vm=6 ml×22.4 L·ml−1=134.4 L。故标准状况时与12 g H2体积相等的N2的物质的量为6 ml,体积为134.4 L,质量为6 ml×28 g·ml−1=168 g。
8.【答案】C
【解析】标准状况下G的体积为4.48 L,其物质的量为=0.2 ml,则摩尔质量为=30 g/ml,A、CH4的摩尔质量为16 g/ml,不符合;B、O2的摩尔质量为32 g/ml,不符合;C、NO的摩尔质量为30 g/ml,符合;D、NH3的摩尔质量为17 g/ml,不符合。答案选C。
9.【答案】B
【解析】设该气体的摩尔质量为M,则 QUOTE =b,所以M=g· ml−1。c g该气体在标准状况下的体积为 QUOTE ×22.4L·ml−1= QUOTE L。
10.【答案】D
【解析】根据n=可知,分子数与物质的量成正比。A、根据n=可知,质量相等时,物质的量与摩尔质量成反比,N2和CO2的摩尔质量不同,所以其物质的量不同,分子数不同,故A错误;B、同质量的H2和N2,二者同质量,摩尔质量不相同,则物质的量不同,故B错误;C、根据pV=nRT可知,二者体积相同,由于压强和温度不一定相同,所以物质的量不一定相等,故C错误;D、相同物质的量的N2O和CO2,也就是分子数相同,故D正确。故选D。
【答案】B
解析:两容器的温度和压强军相同,且气体质量相等,而甲的密度大于乙的密度,由密度公式可知V甲
12.【答案】B
【解析】含1 ml O的CO、CO2、O3的物质的量分别是1 ml、ml、ml,三者之比为6∶3∶2,A错误;n g Cl2物质的量为ml,含Cl原子数×NA×2=m,NA=,B正确;摩尔质量的单位为g·ml−1,C错误;未说明温度、压强状况,不能进行气体体积与物质的量的一切相关计算和比较,D错误。
13.【答案】(1)往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用手将试管底部捂热,若观察到广口瓶中长玻璃管内液面上升,松开手后,过一会儿长玻璃管内的液面下降,则证明该装置不漏气
(2) ②①③ 偏小
(3) 0.012 5 22. 38 L/ml
【解析】(1)往广口瓶中装满水,使装置左侧形成密闭体系,通过捂热试管看广口瓶中长导管液面高度的变化来判断装置气密性。
(2) 在测量收集到O2的体积时,先将装置中的气体冷却至室温,然后调整量筒高度,使量筒内液面和广口瓶中液面相平,最后再读取量筒内水的体积。读数时若仰视量筒内的液面,会使读取O2的体积偏小。
(3) 根据质量守恒定律,产生O2的质量为:15.95 g−15.55 g=0.4 g。n(O2)==0.0125 m1,则Vm= QUOTE =22.38 L/ml。相同条件
结论
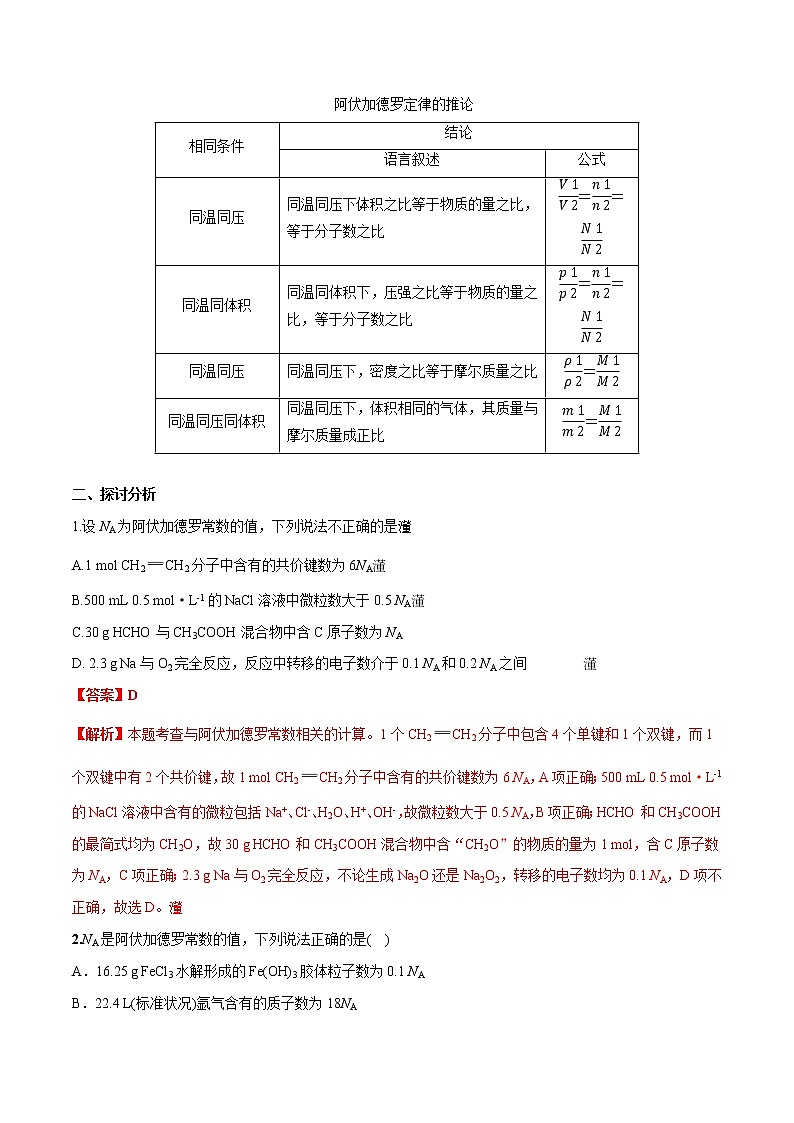
语言叙述
公式
同温同压
同温同压下,体积之比等于物质的量之比,等于分子数之比
eq \f(V1,V2)=eq \f(n1,n2)=eq \f(N1,N2)
同温同体积
同温同体积下,压强之比等于物质的量之比,等于分子数之比
eq \f(p1,p2)=eq \f(n1,n2)=eq \f(N1,N2)
同温同压
同温同压下,密度之比等于摩尔质量之比
eq \f(ρ1,ρ2)=eq \f(M1,M2)
同温同压同体积
同温同压下,体积相同的气体,其质量与摩尔质量成正比
eq \f(m1,m2)=eq \f(M1,M2)
2024届高考化学一轮复习专题1第2讲物质的量气体摩尔体积基础学案: 这是一份2024届高考化学一轮复习专题1第2讲物质的量气体摩尔体积基础学案,共26页。
鲁科版高考化学一轮复习第1章第1讲物质的量气体摩尔体积教学课时学案: 这是一份鲁科版高考化学一轮复习第1章第1讲物质的量气体摩尔体积教学课时学案,共25页。
新高考化学一轮复习精品学案 第2章 第6讲 物质的量 气体摩尔体积(含解析): 这是一份新高考化学一轮复习精品学案 第2章 第6讲 物质的量 气体摩尔体积(含解析),共11页。












