

高考一轮复习第九课第1节:碳、硅单质学案
展开
这是一份高考一轮复习第九课第1节:碳、硅单质学案,共11页。
知识介绍
●硅单质
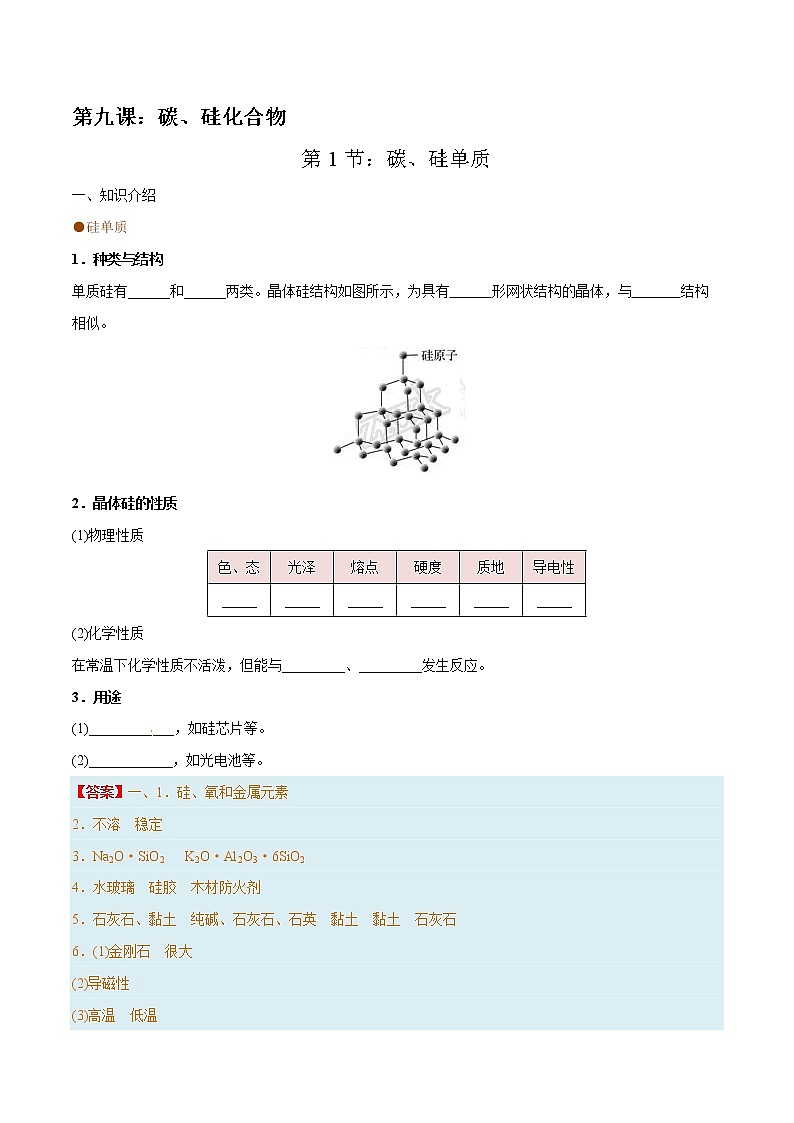
1.种类与结构
单质硅有______和______两类。晶体硅结构如图所示,为具有 形网状结构的晶体,与 结构相似。
2.晶体硅的性质
(1)物理性质
(2)化学性质
在常温下化学性质不活泼,但能与_________、_________发生反应。
3.用途
(1)____________,如硅芯片等。
(2)____________,如光电池等。
【答案】一、1.硅、氧和金属元素
2.不溶 稳定
3.Na2O·SiO2 K2O·Al2O3·6SiO2
4.水玻璃 硅胶 木材防火剂
5.石灰石、黏土 纯碱、石灰石、石英 黏土 黏土 石灰石
6.(1)金刚石 很大
(2)导磁性
(3)高温 低温
(4)吸附剂 催化剂
二、1.晶体 无定形 正四面体 金刚石
2.(1)灰黑色固体 金属光泽 高 大 脆 半导体
(2)氢氟酸 强碱
3.(1)制作半导体材料
(2)制作新型能源
◈硅单质性质的特殊性
硅原子最外层有4个电子,得失电子都较难,化学性质不活泼。常温下,除与F2、HF和强碱溶液反应外,硅不与其他物质(如强酸和强氧化剂)反应。加热时,硅能与O2、Cl2、C发生化合反应。
(1)一般情况下,非金属元素单质熔、沸点低,硬度小,但晶体硅和金刚石熔、沸点高,硬度大,其中金刚石为自然界中硬度最大的物质。
(2)一般情况下,非金属单质为绝缘体,但硅为半导体,石墨为电的良导体。
(3)Si的还原性大于C,但单质C在高温下能从SiO2中还原出Si:SiO2+2CSi+2CO↑。
(4)非金属单质与碱反应一般既作氧化剂又作还原剂,且无氢气放出,但硅与碱溶液反应只作还原剂,且反应能放出氢气:Si+2NaOH+H2O===Na2SiO3+2H2↑。
(5)非金属单质一般不与非氧化性酸反应,但硅能与氢氟酸反应:Si+4HF===SiF4↑+2H2↑。
⊙硅的工业制法
(1)四氯化硅还原法
①工艺流程
石英砂粗硅SiCl4高纯硅
②反应原理
Si(粗)+2Cl2SiCl4
SiCl4+2H2Si(纯)+4HCl
(2)三氯甲硅烷还原法制备高纯度硅(常用方法)
①工艺流程
②反应原理
SiO2+2CSi+2CO↑,
Si+3HClSiHCl3+H2,
SiHCl3+H2Si+3HCl。
❊碳的单质
1.物质的结构决定性质
同一种元素可以组成不同的单质,以单质形式存在的碳有金刚石、石墨和等,由于它们的碳原子排列方式不同,即结构不同,它们的性质也存在较大的差异。由此也可以知道:物质的结构决定其性质。这三种常见单质的空间排列如图所示。
金刚石的结构 石墨的结构 的结构
2.金刚石、石墨和C60的比较
3.无定形碳
无定形碳:由石墨的微小晶体和少量杂质构成,没有固定形状。常见的无定形碳:木炭、活性炭、焦炭、炭黑。
4.碳的单质相关概念辨析
(1)由同种元素组成的不同单质,如金刚石和石墨、红磷和白磷等,其物理性质不同,但化学性质基本相同。
(2)同种元素组成的不同单质间可以相互转化,如石墨在一定条件下能转化为金刚石,这一转化过程中产生了新物质,属于化学变化,而不是物理变化。
(3)木炭和活性炭的吸附性是物理性质,所以木炭、活性炭对其他物质的脱色过程是物理变化。
(4)“碳”和“炭”的区别:“碳”是元素名称,是核电荷数为6的一类原子的总称,并不具体指某种物质。如碳元素、碳单质、二氧化碳等使用“碳”。“炭”只在木炭、活性炭、炭黑、焦炭等无定形碳的物质名称中使用。
✦碳的化学性质
1.常温下,碳单质的化学性质稳定
在常温下,碳的化学性质不活泼。碳受日光照射或与空气、水等接触都不容易起变化。
实际生活中利用这一性质有以下应用:
(1)需要长期保存的档案材料一般用碳素墨水书写。
(2)木质电线杆埋入地下部分用火烧焦。
2.碳能与氧气反应——可燃性
在点燃的条件下,碳可以在氧气(或空气)里燃烧,放出热量。
(1)氧气充足时,完全燃烧:C+O2CO2
(2)氧气不充足时,不完全燃烧:2C+O22CO
无论碳燃烧是否充分,都会放出热量,因此碳是生活生产中常用的燃料。
3.碳能与某些金属氧化物反应——还原性
单质碳在高温下可以和某些氧化物反应,夺取这些氧化物中的氧,表现出还原性。
(1)木炭还原氧化铜
①实验操作
a.把刚烘干的木炭粉末和氧化铜粉末混合均匀,小心地铺放进试管;
b.将试管固定在铁架台上。试管口装有通入澄清石灰水的导管;
c.集中加热;
d.过几分钟后,先撤出导气管,待试管冷却后再把试管里的粉末倒在纸上。观察现象并分析。
②实验现象
澄清的石灰水变浑浊;黑色固体逐渐变成红色。
③实验原理
C+2CuO2Cu+CO2↑
在碳还原氧化铜的反应中,C在反应中得到氧,发生氧化反应,具有还原性。CuO在反应中失去氧,发生还原反应,具有氧化性。
④实验操作目的及注意事项
a.反应开始的标志:澄清的石灰水变浑浊。
b.试管口应略向下倾斜:防止冷凝水倒流使试管炸裂。
c.在酒精灯上加网罩的目的:使火焰集中并提高温度。
d.配制混合物时木炭粉应稍过量的目的:防止已经还原的铜被氧气重新氧化。
e.实验完毕后先熄灭酒精灯的后果:石灰水倒吸入热的试管中使试管炸裂。
(2)工业上,用焦炭和铁的氧化物反应冶炼铁:2Fe2O3+3C4Fe+3CO2↑
(3)高温下,木炭还能与二氧化碳反应:C+CO22CO↑
◑氧化反应与还原反应
1.氧化反应、还原反应
物质与氧发生的反应叫做氧化反应。含氧化合物中的氧被夺去的反应叫做还原反应。简记为“得氧被氧化,失氧被还原”。
2.氧化性、还原性
在反应中物质供给氧的性质叫做氧化性,物质夺取氧的性质叫做还原性。
在2CuO+C2Cu+CO2↑反应里,氧化铜失去氧而变成了铜单质,氧化铜发生还原反应。木炭是使氧化铜还原为铜的物质,它具有还原性,是还原剂。木炭跟氧化铜里的氧起反应生成了二氧化碳,又发生了氧化反应。氧化铜在反应中提供氧,具有氧化性,是氧化剂。
氧化反应与还原反应是从得氧失氧的角度研究化学反应的,不属于基本反应类型。氧化剂是指能够供给氧的物质,还原剂是指能够得到氧的物质,氧化剂、还原剂指的都是反应物。氧化反应和还原反应是针对化学反应中的某一反应物而言的,如C与CuO的反应中,C发生了氧化反应,CuO发生了还原反应。
●碳燃烧时生成物的判断
氧气量充足时,碳充分燃烧:C+O2CO2
3 :8 : 11
氧气量不充足时,碳不充分燃烧:2C+O22CO
3 :4 : 7
依据反应的化学方程式可知,碳燃烧后生成何种气体由碳和氧气的质量决定。碳和氧气按一定质量比混合,反应后生成气体的情况可按如图所示数轴记忆(数轴下面的数字是碳和氧气的质量比)。
当m g碳与n g氧气反应时:
(1)时,生成物只有CO2,且O2有剩余。
(2)时,碳和氧气恰好完全反应,生成CO2。
(3)时,碳和氧气均无剩余,生成物既有CO2也有CO。
(4)时,碳和氧气恰好完全反应,生成CO。
(5)时,生成物只有CO,且C有剩余。
二、探究讨论
1.关于金刚石、石墨和C60的说法正确的是
A.都是黑色固体 B.都具有导电性
C.都是由原子直接构成的 D.燃烧都生成二氧化碳
【解析】A、金刚石不是黑色固体,错误;B、金刚石不导电,错误;C、金刚石、石墨是由碳原子构成,但是C60是由分子构成,错误;D、金刚石、石墨和C60都含有碳元素,燃烧后都生成二氧化碳,正确。故选D。
【答案】D
2. 已知:2CuO+C2Cu+CO2↑。如图表示一定质量的CuO和C固体混合物在受热过程中各物质质量随时间的变化趋势。下列说法中,不正确的是
A.t1时,开始发生反应
B.t1和t2时,固体中铜元素质量保持不变
C.c是固体混合物的质量
D.d是二氧化碳的质量
【解析】A、由图像可知,t1时各物质的质量开始发生变化,说明了反应开始发生,正确;B、根据质量守恒定律可知,反应前后固体中铜元素的质量不变,正确;C、根据在方程式中的质量比可知,生成铜的质量要比二氧化碳的质量多,所以c为生成铜的质量,d应为生成二氧化碳的质量,错误;D、由上述分析可知,d应为生成的二氧化碳的质量,正确。故选C。
【答案】C
3. (贵州省六盘水盘县四中2017−2018学年下学期期末考试)下列关于硅的说法不正确的是
A.硅是非金属元素,它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C.加热到一定温度时,硅能与氢气、氧气等非金属反应
D.硅的化学性质不活泼,常温下不与任何物质起反应
【答案】D
【解析】A. 硅是非金属元素,硅单质是灰黑色有金属光泽的固体,A正确;B. 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料,B正确;C. 加热到一定温度时,硅能与氢气、氧气等非金属反应,C正确;D. 硅的化学性质不活泼,常温下能与氢氧化钠溶液以及氢氟酸等反应,D错误。答案选D。
好题精做
1.关于金刚石、石墨、C60的叙述,正确的是
A.都属于碳单质
B.都由碳原子构成
C.都具有导电性
D.完全燃烧产物不同
2.下列关于金刚石和石墨的叙述中,正确的是
A.都无色透明 B.都属于碳单质
C.都没有可燃性 D.都具有导电性
3.石墨烯是单层的石墨,它是已知世界上最薄、最坚硬的新型材料,有良好的导电性,具有很好的应用前景。下列有关石墨烯的说法正确的是
A.与C60是同一物质
B.属于新型的化合物
C.硬度小于金刚石
D.在氧气中燃烧可能生成CO2、CO或二者的混合物
4.在高温条件下,碳能使二氧化碳转变成一氧化碳:C+CO22CO,下列说法不正确的是
A.反应中碳发生了还原反应
B.产物是空气污染物之一
C.该反应为吸热反应
D.该反应中原子数目在反应前后不变
5.下列碳单质的各种用途中,利用其化学性质的是
A.用焦炭冶炼金属 B.用金刚石做钻头
C.用石墨做铅笔芯 D.用活性炭做冰箱除味剂
6.硅被誉为无机非金属材料的主角,下列物品用到硅单质的是
A.陶瓷餐具B.石英钟表C.计算机芯片D.光导纤维
7.硅及其化合物在材料领域中应用广泛。下列说法正确的是
A.光导纤维的主要成分是硅B.水晶项链的主要成分是硅酸盐
C.晶体硅能用来制造太阳能电池D.二氧化硅是一种半导体材料
8.(东北三省三校2018届高三第一次模拟)下列说法不正确的是
A.SiO2能与HF反应,因此可用HF刻蚀玻璃
B.向Na2SiO3溶液中逐滴加入稀盐酸制备硅酸凝胶
C.氮化硅是一种重要的结构陶瓷材料,化学式为Si3N4
D.石英是良好的半导体材料,可以制成光电池,将光能直接转化成电能
9.下列有关硅及其化合物的说法不正确的是
A.晶体硅具有金属光泽,可以导电,属于金属材料
B.常温下,硅的化学性质稳定,自然界中的硅主要以氧化物及硅酸盐的形式存在
C.SiO2是一种酸性氧化物,能够与强碱反应生成相应的盐
D.除去SiO2中混有的CaCO3可加入适量的稀盐酸,然后再过滤
10.(云南省玉溪市一中2017−2018学年高一下学期期末考试)在生产和生活中应用的化学知识正确的是
A.玻璃、水泥、水晶项链都是硅酸盐制品
B.晶体硅是在通信工程中制作光导纤维的主要原料
C.赏心悦目的雕花玻璃通常是用氢氟酸对玻璃进行刻蚀而制成的
D.工业上,利用二氧化硅热分解法冶炼硅
11.下列叙述正确的是
A.Na2SiO3是硅酸盐,但不能溶于水
B.电影银幕用水玻璃浸泡,主要是为了防腐
C.建筑工业常用水玻璃作黏合剂
D.用水玻璃浸泡铁道的木制枕木,主要是为了防火
参考答案
1.【答案】A
【解析】A、金刚石、石墨和C60都是由碳元素组成的纯净物,都属于单质,正确;B、金刚石、石墨由碳原子直接构成,C60是一种由分子(每个分子由60个碳原子构成)构成的单质,错误;C、金刚石没有导电性,错误;D、因为它们都是由碳元素组成的,在氧气中充分燃烧时都生成二氧化碳,错误。故选A。
2.【答案】B
3.【答案】D
【解析】A、石墨烯是由碳原子构成的,是单层的石墨与C60的碳原子排列方式不同,不是同一物质,错误;B、石墨烯是由碳原子构成的,也就是由一种元素组成的纯净物,属于单质,错误;C、石墨烯是单层的石墨,它是已知世界上最薄、最坚硬的新型材料硬度大于金刚石,错误;D、石墨烯由碳元素一种元素组成,所以完全燃烧时,碳与氧结合生成二氧化碳,不完全燃烧生成一氧化碳,正确。故选D。
4.【答案】A
【解析】A、碳夺取了二氧化碳中的氧,发生了氧化反应,故选项说法错误;B、生成物是一氧化碳,是空气污染物之一,故选项说法正确;C、该反应在高温下进行,为吸热反应,故选项说法正确;D、由质量守恒定律,该反应中原子数目在反应前后不变,故选项说法正确。故选A。
5.【答案】A
【解析】A、用焦炭冶炼金属,是利用了焦炭的还原性,利用了焦炭的化学性质,正确;B、用金刚石做钻头,是利用了金刚石的硬度大,利用了其物理性质,错误;C、用石墨做铅笔芯,石墨质软,在纸上划能留下痕迹,利用了其物理性质,错误;D、用活性炭吸附异味,是利用了活性炭的吸附性,利用了其物理性质,错误。故选A。
6.【答案】C
【解析】计算机芯片用的是硅芯片,只有C项正确。
7.【答案】C
【解析】A.光导纤维的主要成分为二氧化硅,错误,不选A;B.水晶的主要成分为二氧化硅,错误,不选B;C.晶体硅可以制造太阳能电池,正确,选C;D.硅是半导体,而二氧化硅不是,错误,不选D。
8.【答案】D
【解析】A. SiO2能与HF反应,因此可用HF刻蚀玻璃,A正确;B. 向Na2SiO3溶液中逐滴加入稀盐酸制备硅酸凝胶,B正确;C. 氮化硅是一种重要的结构陶瓷材料,化学式为Si3N4,C正确;D. 硅是良好的半导体材料,可以制成光电池,将光能直接转化成电能,不是石英,D错误,答案选D。
9.【答案】A
【解析】A项,晶体硅虽然具有金属光泽,但它属于非金属单质,其导电性介于导体和绝缘体之间,是良好的半导体材料;B项,虽然常温下硅的化学性质稳定,但自然界中没有游离态的硅,它主要以二氧化硅和硅酸盐的形式存在;D项,SiO2不溶于稀盐酸,可使用稀盐酸除去其中混有的CaCO3,化学方程式为CaCO3+2HCl===CaCl2+CO2↑+H2O,然后再过滤。
10.【答案】C
【解析】A.水晶的主要成分为二氧化硅是氧化物,不属于硅酸盐,故A错误;B.二氧化硅具有良好的光学特性,是制作光导纤维的主要原料,故B错误;C.常温下氢氟酸能够与玻璃中的二氧化硅反应,所以常用氢氟酸雕刻玻璃,故C正确;D、工业上用SiO2热还原法冶炼硅,而不是热分解法冶炼硅,故D错误;故选C。
11.【答案】C
【解析】Na2SiO3既是硅酸盐,又是钠盐,硅酸盐大多难溶于水,而钠盐均易溶于水;浸泡银幕主要是为了防火,而浸泡枕木主要是为了防腐;水玻璃有黏合作用,常作黏合剂。
色、态
光泽
熔点
硬度
质地
导电性
_____
_____
_____
_____
_____
_____
金刚石
石墨
C60
物理性质
颜色
无色透明
深灰色
─
状态
正八面体形状的固体
细鳞片状固体
形似足球
光泽
加工琢磨有夺目光泽
有金属光泽
─
硬度
天然物质中硬度最大
质软、有滑腻感
─
导电性
不导电
导电性好
有超导性
熔点
很高
很高
─
主要用途
可用来裁玻璃、切割大理石、加工坚硬的金属,制作钻探机钻头,作装饰品(钻石)
作铅笔芯、润滑剂、电极等
材料科学、超导体等
相互关系
─
颜色、状态
制法
用途
木炭
灰黑色的多孔性固体
木材隔绝空气加强热(木材干馏)
燃料、黑火药、制活性炭、冶炼金属
活性炭
灰黑色多孔颗粒状固体
木炭在高温下用水蒸气处理
净化多种气体和液体、作防毒面具
焦炭
浅灰色多孔性固体
煤隔绝空气加强热(煤干馏)
冶炼金属
炭黑
极细的黑色粉末
含碳物质不完全燃烧
墨、油墨、油漆、鞋油、燃料等,作橡胶制品的填料
相关学案
这是一份高考化学 考点18 碳、硅及其化合物(含解析),共13页。学案主要包含了碳族元素,无机非金属材料等内容,欢迎下载使用。
这是一份新高考化学一轮复习精品学案4.1碳硅及其化合物(含解析),共17页。
这是一份专题2.3 碳、硅及其化合物-备战2023年高考化学新编大一轮复习讲义·,文件包含专题23碳硅及其化合物-备战2023年高考化学新编大一轮复习讲义解析版docx、专题23碳硅及其化合物-备战2023年高考化学新编大一轮复习讲义原卷版docx等2份学案配套教学资源,其中学案共34页, 欢迎下载使用。









