


初中化学人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱评课ppt课件
展开
这是一份初中化学人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱评课ppt课件,文件包含101常见的酸和碱pptx、向溶液中加入酸碱指示剂-实验演示视频mp4、对酸碱的初步认识酸碱指示剂的应用视频素材mp4、浓硫酸的稀释-视频实验演示mp4、浓硫酸的腐蚀性-视频实验演示mp4、自制酸碱指示剂-实验演示mp4、酸和碱观察浓硫酸和浓盐酸的性质-实验演示mp4等7份课件配套教学资源,其中PPT共58页, 欢迎下载使用。
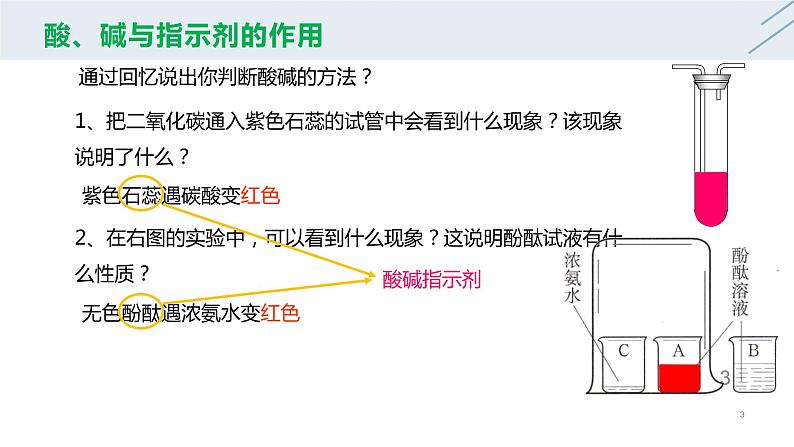
通过回忆说出你判断酸碱的方法?
1、把二氧化碳通入紫色石蕊的试管中会看到什么现象?该现象说明了什么?2、在右图的实验中,可以看到什么现象?这说明酚酞试液有什么性质?
无色酚酞遇浓氨水变红色
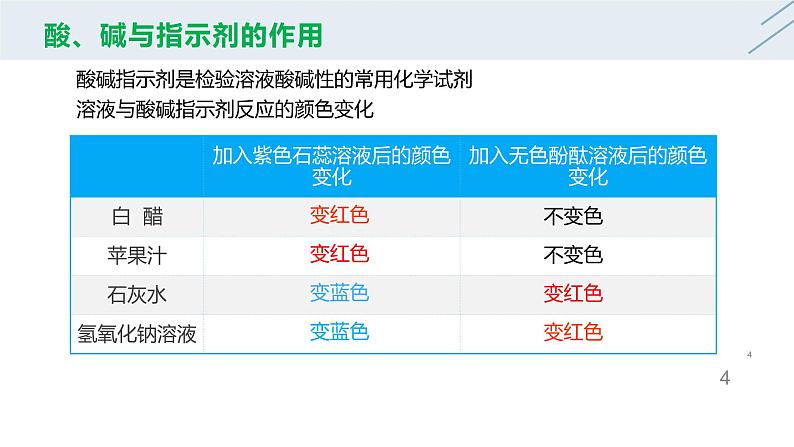
酸碱指示剂是检验溶液酸碱性的常用化学试剂
溶液与酸碱指示剂反应的颜色变化
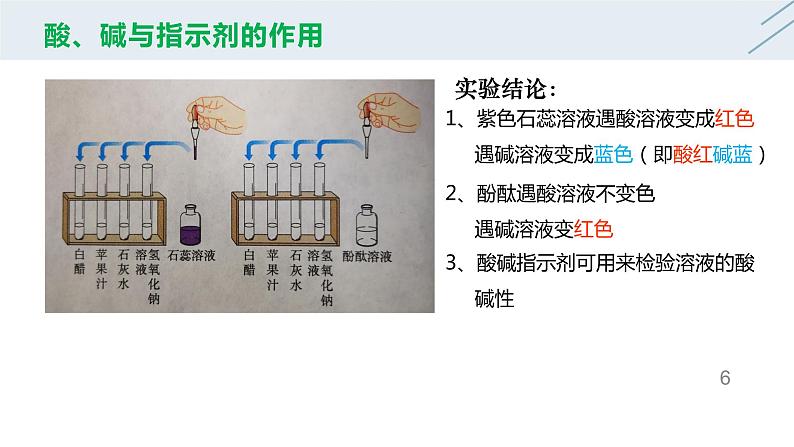
1、紫色石蕊溶液遇酸溶液变成红色 遇碱溶液变成蓝色(即酸红碱蓝)
2、酚酞遇酸溶液不变色 遇碱溶液变红色
3、酸碱指示剂可用来检验溶液的酸 碱性
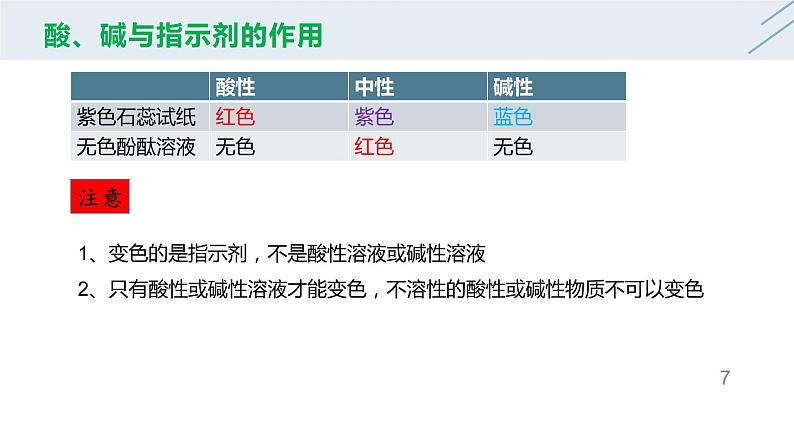
1、变色的是指示剂,不是酸性溶液或碱性溶液2、只有酸性或碱性溶液才能变色,不溶性的酸性或碱性物质不可以变色
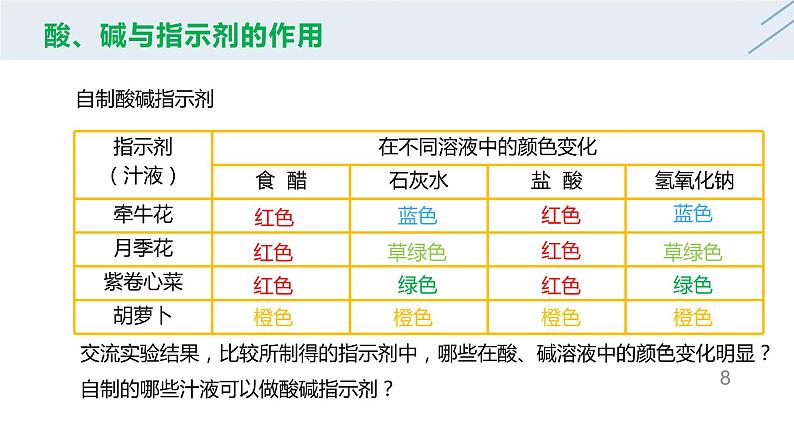
交流实验结果,比较所制得的指示剂中,哪些在酸、碱溶液中的颜色变化明显?自制的哪些汁液可以做酸碱指示剂?
1.某同学在化学晚会上用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四个字,然后再喷上另一种无色液体,白纸上立即出现了红色的“化学魔术”四个字。该同学所用的两种无色液体可能是( )A.NaOH溶液、酚酞溶液B.白醋、紫色石蕊试液C.食盐水、酚酞溶液D.“雪碧”饮料、酚酞溶液
2.在紫甘蓝提取的液汁中分别加入厨房中的下列物质,显色情况如下表:
则加入紫甘蓝提取液显示绿色的是( )A.橙汁B.苹果汁C.蒸馏水D.石灰水
3.使酚酞试液变红的溶液能使紫色石蕊试液呈( )A.无色B.蓝色C.红色D.紫色
4.下列说法中不正确的是( )A.石蕊试液是一种酸碱指示剂B.酸溶液能使红色石蕊试纸变蓝C.酸溶液中都含有氢离子(H+)D.碱溶液中都含有氢氧根离子(OH﹣)
酸定义:解离出来的阴离子只有H+的化合物常见的酸
重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
1、探究盐酸、硫酸的物理性质,了解其用途。
常用浓盐酸1.19g/cm3
常用浓硫酸1.84g/cm3
重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。浓硫酸有吸水性,在实验室中常用它做干燥剂。
把浓盐酸和浓硫酸开盖放置一段时间,各量之间的变化情况
原因:浓盐酸具有挥发性、浓硫酸具有吸水性。
在实验室和化工生产中常用的酸还有硝酸(HNO3)、醋酸(CH3COOH)等
1.分别将一小烧杯浓盐酸,浓硫酸露置在空气中一段时间后,发生的共同变化是( )A.溶液的质量减小B.溶剂的质量增大C.溶质的质量减小D.溶液的溶质质量分数减小
2.浓盐酸敞口时能闻到刺激性气味,说明浓盐酸具有( )A.挥发性B.腐蚀性C.吸水性D.酸性
3.人胃液里含有少量可以帮助消化的酸是( )A.醋酸B.乳酸C.硫酸D.盐酸
4.下列关于盐酸、硫酸的叙述正确的是( )A.打开浓盐酸试剂瓶瓶塞,瓶口冒白雾B.浓盐酸敞口放置后,其溶质质量分数增大C.浓硫酸具有脱水性,故能做干燥剂D.浓硫酸溶于水时会吸热
纸上沾了浓硫酸的地方变黑(炭化)
布上沾浓硫酸的地方炭化、穿孔
木棍上沾了浓硫酸的地方炭化
浓硫酸有强烈的腐蚀性。它能夺取纸张、木材、布料(都由含碳、氢、氧等元素的化合物组成)里的水分,生成黑色的炭。不要将浓硫酸沾到皮肤或者衣服上
将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅拌,并用手轻轻触碰烧杯外壁,有什么感觉?
结论:手触碰的感觉:烧杯发烫。说明浓硫酸溶于水放热
石蕊试液遇酸变成红色酚酞试液遇酸不变色
(2)酸与活泼金属反应
酸+活泼金属 →盐 + 氢气
Mg+2HCl=MgCl2 +H2 ↑Zn+2HCl=ZnCl2 +H2 ↑Fe+2HCl=FeCl2 +H2↑
Mg+H2SO4=MgSO4+H2 ↑Zn+H2SO4=ZnSO4+H2 ↑Fe+H2SO4=FeSO4+H2↑
讨论:上面反应的生成物有什么共同之处?
上述反应都会生成氢气,另一生成物是金属离子与酸根离子构成的化合物(盐)
回忆第八单元所学的几种金属分别与稀盐酸和稀硫酸的反应,填写下表
铁锈消失,铁钉变得光亮,无色溶液变黄
Fe2O3 + 6HCl = 2FeCl3+ 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
讨论:①上面反应的生成物有什么共同之处?
②利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?
不能长时间浸在酸中,因为酸会与金属继续反应,造成金属制品的腐蚀。
酸+金属氧化物 →盐 + 水
反应的生成物之一都是水,另一生成物是金属离子与酸根离子构成的化合物(盐)
CaCO3+2 HCl = CaCl2+ H2O+CO2
Na2CO3+2HCl=NaCl+H2O+CO2
酸+盐 →新盐 + 新酸
酸+碱 →新碱+ 新酸
(4)根据上面的实验和讨论,试归纳出盐酸、硫酸等酸有哪些相似的化学性质。
盐酸、硫酸等酸溶液能使紫色石蕊溶液变红色,遇无色酚酞溶液不变色。
1.下列关于酸的说法正确的是( )A.都含有氧元素B.能与碱反应生成盐和水的物质都是酸C.都能与金属反应生成氢气D.都能解离出H+
3.现今有些药房出售“冲泡式”感冒药。这类药剂经温水调和,杯中会有气泡,饮用方便。冲泡式感冒药剂之所以会有气泡,是因其含有柠檬酸以及下列物质中的( )A.碳酸氢钠B.氢氧化镁C.阿司匹林D.咖啡因
4.下列实验现象描述错误的是( )A.铁钉放入稀盐酸中:银白色固体逐渐减少至消失,固体表面会产生气泡,放热B.向氧化铁中加入足量稀盐酸:红棕色粉末逐渐减少至消失,溶液由无色变为黄色,放热C.铝丝浸入硫酸铜溶液后,银白色固体表面有紫红色固体生成,溶液由蓝色逐渐变为无色D.打开盛有浓盐酸的试剂瓶盖,在瓶口出现大量白烟
5.盐酸、硫酸是两种重要的酸,回答下列问题。(1)实验室常用浓硫酸来干燥O2、CO2等气体,是因为浓硫酸具有 性。(2)用盐酸可以将铝壶内壁上的水垢[主要成分是Mg(OH)2和CaCO3]除去,写出其中发生的反应是中和反应的化学方程式 。但所用盐酸不能过量,否则,铝壶将被腐蚀,其原因是 (用化学方程式表示)。(3)稀盐酸、稀硫酸都可用来除铁锈,写出用盐酸除铁锈的化学方程式: 。
(1)浓硫酸具有吸水性,可作干燥剂,故填:吸水;(2)酸和碱生成盐和水的反应为中和反应,则水垢中氢氧化镁与盐酸反应生成氯化镁和水的反应属于中和反应,则反应方程式为Mg(OH)2+2HCl=MgCl2+2H2O;铝与盐酸反应生成氯化铝和氢气,则反应的化学方程式2Al+6HCl=2AlCl3+3H2↑;故填:Mg(OH)2+2HCl=MgCl2+2H2O;2Al+6HCl=2AlCl3+3H2↑;(3)铁锈的主要成分是氧化铁,氧化铁与盐酸反应生成氯化铁和水,则反应方程式为Fe2O3+6HCl=2FeCl3+3H2O,故填:Fe2O3+6HCl=2FeCl3+3H2O。
6.构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的化学性质知识网络,如图所示,请结合图示回答下列问题。(1)图中①的现象是 。(2)写出一个符合图中②的化学方程式: 。(3)为了验证反应③能够发生,应选择的物质是 (填序号)。A.NaCl溶液B.AgNO3溶液C.NaOH溶液D.MgCl2溶液
(4)图中性质④属于 (填基本反应类型)反应。(5)图中⑤的性质在工业上可用于 (填用途)。(6)如果用湿润的pH试纸测定盐酸的pH,则结果会 (选填“偏大”“偏小”或“无影响”)。
(1)溶液变红色。(2)Fe+2HCl═FeCl2+H2↑。(3)B。(4)复分解。(5)除锈。(6)偏大。
用镊子夹取3小块氢氧化钠分别进行试验
潮解 物质暴露在空气中吸收水分并逐渐溶解的现象
NaOH可以做干燥剂,干燥H2、O2、NH3等气体(不能干燥CO2、SO2等)
氢氧化钠是一种常见的碱,俗名苛性钠、火碱或烧碱,有强烈的腐蚀性
①使用NaOH 必须十分小心,防止眼睛、皮肤、衣服被腐蚀
②不慎将NaOH沾到皮肤上,立即用大量的清水冲洗,再涂上硼酸溶液
③NaOH易吸收空气中的水分而发生潮解,可用作某些气体的干燥剂
④NaOH是一种重要的化工原料,广泛用于肥皂、石油、造纸、纺织、印染等工业
⑤ NaOH能与油脂反应,在生活中可用来去除油污
氢氧化钙的物理、化学性质探究
白色固体没有完全溶于水,呈浑浊状态
常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)
(2)碱与CO2反应(与非金属氧化物反应)
碱溶液 + 非金属氧化物 → 盐 + 水
要与空气中的水蒸气发生潮解,与空气中的二氧化碳反应生成盐和水
①盐酸、硫酸、氢氧化钠溶液、氢氧化钙溶液导电,说明上述四种溶液中存在着自由移动的粒子。
②酸在水溶液中能解离出H+和酸根离子,不同的酸溶液都含H+,所以酸的性质相似;碱在水溶液中能解离出OH-和金属离子。不同的碱溶液都含OH-,所以碱的性质相似。
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
NaOH =Na+ + OH-
Ca(OH)2=Ca2+ + 2OH-
在不同的酸溶液中都含有相同的H+,所以酸有一些相似的性质。
碱溶液中也含有相同的OH-,所以,碱也有一些相似的性质。
由于溶液中存在自由移动的带电粒子,在外加电场的作用下定向移动,从而导电。
试着归纳电离方程式书写原则
1.下列物质放在空气中易潮解的是( )A.碳酸钙B.纯碱C.烧碱D.生石灰
2.下列常用来改良酸性土壤的物质是( )A.熟石灰B.硫酸C.烧碱D.食盐
3.氢氧化钠的俗称是( )A.纯碱B.小苏打C.熟石灰D.烧碱
5.物质的性质决定其用途。固体氢氧化钠可用作干燥剂,是利用了它的哪种性质( )A.白色固体B.吸水性C.腐蚀性D.能与空气中的二氧化碳反应
6.下列关于氢氧化钠的说法正确的是( )A.实验室称量氢氧化钠时可以将氢氧化钠放在纸上称量B.氢氧化钠易潮解,要密封保存C.不小心将浓硫酸沾到皮肤上,应立即用氢氧化钠进行中和,然后用大量的水冲洗D.溶于水放出大量热的白色固体一定是氢氧化钠
7.归纳总结是学习化学的一种方法。莉莉整理的氢氧化钠的化学性质如图。结合此图回答下列问题。(1)氢氧化钠能与某些非金属氧化物反应,暴露在空气中易变质,反应的化学方程式为 。所以要密封保存。实验室须密封保存的物质还有 (填名称)。(2)为验证X与氢氧化钠溶液的反应,应该选择的物质是 (填序号)。A.CO2B.HClC.FeCl3D.Na2CO3
(1)CO2+2NaOH═Na2CO3+H2O;浓盐酸(或浓硫酸、氢氧化钙、氧化钙等);(2)C。
8.同学们通过如图实验研究氢氧化钙的性质。
(1)Ca(OH)2的水溶液显碱性的主要原因是溶液中含有 (用符号表示)。(2)观察到试管a中有固体剩余,加热后固体 (填“消失”或“不消失”)。(3)试管b中观察到的现象是 。试管中所发生变化的实质是 。
(1)OH﹣;(2)不消失;(3)固体消失、红色溶液变为无色;氢离子与氢氧根离子结合生成水分子。
相关课件
这是一份人教版九年级下册第十单元 酸和碱课题1 常见的酸和碱课文内容课件ppt,共37页。PPT课件主要包含了新课导入,几种常见的碱,白色块状固体,表面潮湿,试管外壁温度较高,溶解时放热,炉具清洁剂,碱的化学性质,变为蓝色,变为红色等内容,欢迎下载使用。
这是一份化学九年级下册课题1 常见的酸和碱多媒体教学课件ppt,共12页。PPT课件主要包含了新课导入,酸的化学性质,不变色无色,典型例题等内容,欢迎下载使用。
这是一份化学九年级下册课题1 常见的酸和碱课文ppt课件,共18页。PPT课件主要包含了新课导入,硫酸罐车侧翻,常见的酸,不易挥发,有刺激性气味,浓盐酸,浓硫酸,柠檬中含有柠檬酸,食醋中含有醋酸,浓硫酸的腐蚀性等内容,欢迎下载使用。










