

2022届高三化学一轮复习-第八章 第2讲 水的电离和溶液的pH 第1课时讲义(考纲+知识点+检测)学案
展开第八章水溶液中的离子平衡
第2讲 水的电离和溶液的pH
第一课时
[考纲要求]
1.了解水的电离、离子积常数。
2.了解溶液pH的定义。了解测定溶液pH的方法,能进行pH的简单计算。
3.能根据中和滴定实验试题要求,分析或处理实验数据,得出合理结论。
考点一 水的电离平衡
1知识梳理
1.水的电离
水是极弱的电解质,水的电离方程式为______________________或________________________。
2.水的离子积常数
Kw=c(H+)·c(OH-)。
(1)室温下:Kw=__________。
(2)影响因素:只与____有关,升高温度,Kw____。
(3)适用范围:Kw不仅适用于纯水,也适用于稀的________水溶液。
(4)Kw揭示了在任何水溶液中均存在H+和OH-,只要温度不变,Kw不变。
3.影响水电离平衡的因素
(1)升高温度,水的电离程度________,Kw________。
(2)加入酸或碱,水的电离程度________,Kw________。
(3)加入可水解的盐(如FeCl3、Na2CO3),水的电离程度________,Kw________。
[思考]
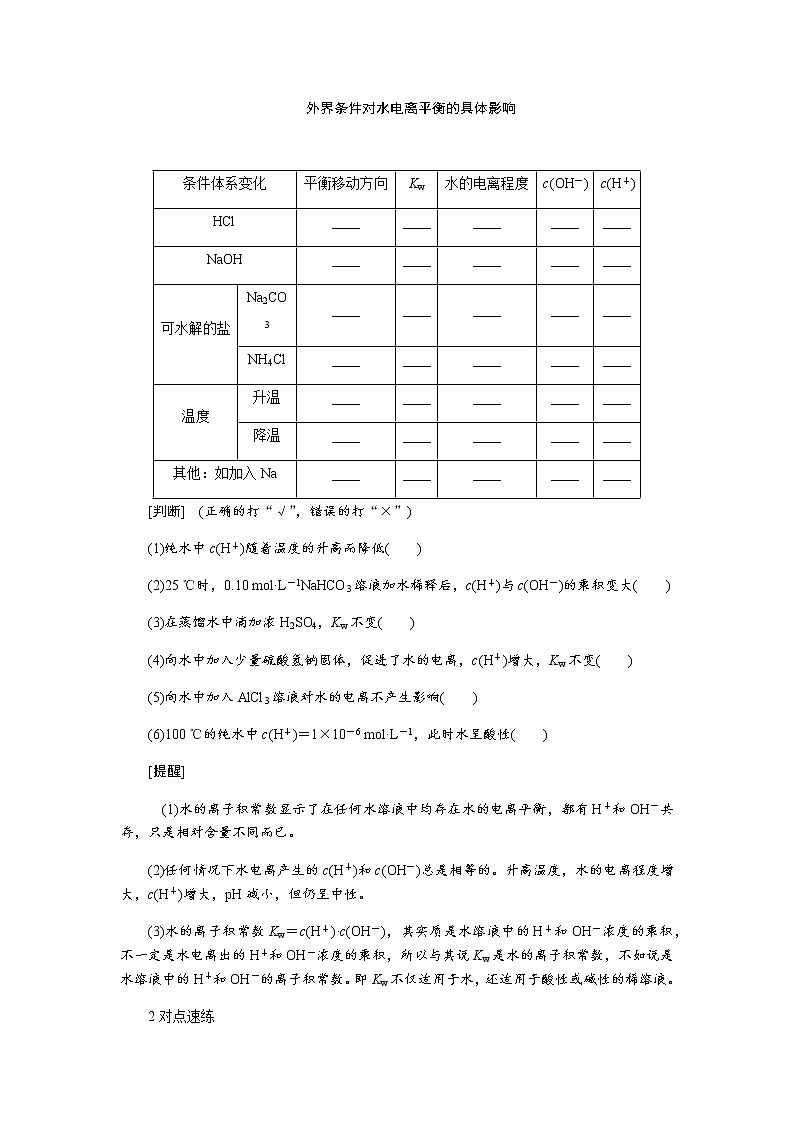
外界条件对水电离平衡的具体影响
条件体系变化 | 平衡移动方向 | Kw | 水的电离程度 | c(OH-) | c(H+) | |
HCl | ____ | ____ | ____ | ____ | ____ | |
NaOH | ____ | ____ | ____ | ____ | ____ | |
可水解的盐 | Na2CO3 | ____ | ____ | ____ | ____ | ____ |
NH4Cl | ____ | ____ | ____ | ____ | ____ | |
温度 | 升温 | ____ | ____ | ____ | ____ | ____ |
降温 | ____ | ____ | ____ | ____ | ____ | |
其他:如加入Na | ____ | ____ | ____ | ____ | ____ | |
[判断] (正确的打“√”,错误的打“×”)
(1)纯水中c(H+)随着温度的升高而降低( )
(2)25 ℃时,0.10 mol·L-1NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积变大( )
(3)在蒸馏水中滴加浓H2SO4,Kw不变( )
(4)向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变( )
(5)向水中加入AlCl3溶液对水的电离不产生影响( )
(6)100 ℃的纯水中c(H+)=1×10-6 mol·L-1,此时水呈酸性( )
[提醒]
(1)水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
(2)任何情况下水电离产生的c(H+)和c(OH-)总是相等的。升高温度,水的电离程度增大,c(H+)增大,pH减小,但仍呈中性。
(3)水的离子积常数Kw=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说Kw是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。即Kw不仅适用于水,还适用于酸性或碱性的稀溶液。
2对点速练
练点一 水的电离平衡判断
1.一定温度下,水存在H2O⇌H++OH- ΔH>0的平衡,下列叙述一定正确的是( )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变
2.下列有关水电离情况的说法正确的是( )
A.100 ℃时,Kw=10-12,此温度下pH=7的溶液一定呈中性
B.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用
C.25 ℃时,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同
D.如图为水的电离平衡曲线,若从A点到C点,可采用升高温度的方法
练后归纳
正确理解水的电离平衡曲线
(1)曲线上任意点的Kw都相同,即c(H+)·c(OH-)相同,温度相同。
(2)曲线外在任意点与曲线上任意点的Kw不同,温度不同。
(3)实现曲线上点之间的转化需保持温度不变,改变酸碱性;实现曲线上点与曲线外点之间的转化一定得改变温度。
练点二 水电离程度大小比较
3.若往20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是( )
A.c点时,醋酸的电离程度和电离常数都最大,溶液呈中性
B.若b点混合溶液显酸性,则2c(Na+)=c(CH3COO-)+c(CH3COOH)
C.混合溶液中水的电离程度:b>c>d
D.由图可知,该反应的中和热先增大后减小
4.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
5.25 ℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )
A.由图可知BOH一定是强碱
B.Ka(HA)=1×10-6
C.b点时,c(B-)=c(A-)=c(OH-)=c(H+)
D.a→b过程中水的电离程度始终增大
6.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | Kw | 1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则Kw________(填“>”“<”或“=”)1×10-14,做出此判断的理由是________。
(2)在t1 ℃时,测得纯水中的c(H+)=2.4×10-7 mol·L-1,则c(OH-)为________。该温度下,测得某H2SO4溶液中c(S)=5×10-6 mol·L-1,该溶液中c(OH-)=________ mol·L-1。
第八章水溶液中的离子平衡
第2讲 水的电离和溶液的pH
第一课时答案
考点一
1知识梳理
1.H2O+H2OH3O++OH- H2OH++OH-
2.(1)1×10-14 (2)温度 增大 (3)电解质
3.(1)增大 增大 (2)减小 不变 (3)增大 不变
思考 答案:
逆 不变 减小 减小 增大
逆 不变 减小 增大 减小
正 不变 增大 增大 减小
正 不变 增大 减小 增大
正 增大 增大 增大 增大
逆 减小 减小 减小 减小
正 不变 增大 增大 减小
判断 答案:(1)× (2)× (3)× (4)× (5)× (6)×
2对点速练
1.解析:A项,Kw应不变;C项,平衡应正向移动;D项,由于没有指明温度,c(H+)不一定等于10-7 mol·L-1。
答案:B
2.解析:100 ℃时,Kw=c(H+)·c(OH-)=10-12,中性溶液中c(H+)=c(OH-)==10-6 mol·L-1,即pH=6,此温度下pH=7的溶液呈碱性,A项错误;NH4Cl、CH3COONa、NaHCO3促进水的电离,NaHSO4抑制水的电离,B项错误;烧碱是NaOH,抑制水的电离,纯碱是Na2CO3,促进水的电离,C项错误;图中A点到C点,c(H+)与c(OH-)同等程度增大,说明是温度升高的结果,D项正确。
答案:D
3.解析:c点时,CH3COOH和NaOH恰好完全反应,得到CH3COONa溶液,由于CH3COO-水解,溶液呈碱性,A项错误;b点时,反应得到等物质的量浓度的CH3COOH、CH3COONa的混合溶液,根据物料守恒得2c(Na+)=c(CH3COOH)+c(CH3COO-),B项正确;b点为等物质的量浓度的CH3COOH、CH3COONa的混合溶液,c点为CH3COONa溶液,d点为等物质的量浓度的NaOH、CH3COONa的混合溶液,故c点水的电离程度最大,C项错误;中和热与酸碱的用量无关 ,中和热保持不变,D项错误。
答案:B
4.解析:由水的离子积的定义知两条曲线间任意点均有c(H+)·c(OH-)=Kw,A项正确;由图中纵横轴的大小可知M区域内任意点均有c(H+)<c(OH-),B项正确;温度越高,水的电离程度越大,电离出的c(H+)与c(OH-)越大,所以T2>T1,C项正确;XZ线上任意点都有c(H+)=c(OH-),只有当c(H+)=10-7mol·L-1时,才有pH=7,D项错误。
答案:D
5.解析:根据图知,0.1 mol·L-1HA溶液的pH=3,则c(H+)<0.1 mol·L-1,说明HA是弱酸;0.1 mol·L-1BOH溶液的pH=11,c(OH-)<0.1 mol·L-1,则BOH是弱碱,A项错误;Ka(HA)==≈1×10-5,B项错误;b点是两者等体积混合溶液呈中性,c(B-)=c(A-),c(OH-)=c(H+),盐电离产生离子的浓度远大于水电离产生的离子浓度,故c(B-)=c(A-)>c(OH-)=c(H+),C项错误;HA是弱酸,酸电离产生的H+对水的电离平衡起抑制作用,在a→b过程中,酸被碱中和,溶液中酸电离产生的c(H+)减小,其对水的电离的抑制作用减弱,同时生成弱酸弱碱盐(BA)对水的电离起促进作用,故a→b过程中水的电离程度始终增大,D项正确。
答案:D
6.解析:(1)水是弱电解质,存在电离平衡,电离吸热,所以温度升高,水的电离程度增大 ,离子积增大。
(2)水电离出的氢离子浓度和氢氧根离子浓度相同,某温度下纯水中的c(H+)=2.4×10-7 mol·L-1,则此时纯水中的c(OH-)=2.4×10-7 mol·L-1,Kw=2.4×10-7×2.4×10-7=5.76×10-14。该温度下,某H2SO4溶液中c(S)=5×10-6 mol·L-1,则溶液中氢离子浓度是1×10-5 mol·L-1,c(OH-)=mol·L-1=5.76×10-9 mol·L-1。
答案:(1)> 水的电离是吸热过程,升高温度,平衡向正反应方向移动,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),Kw增大
(2)2.4×10-7 mol·L-1 5.76×10-9
新高考化学一轮复习精品学案 第9章 第52讲 水的电离和溶液的pH(含解析): 这是一份新高考化学一轮复习精品学案 第9章 第52讲 水的电离和溶液的pH(含解析),共15页。
2024年高考化学一轮复习 第49讲 水的电离和溶液的pH 学案(含答案): 这是一份2024年高考化学一轮复习 第49讲 水的电离和溶液的pH 学案(含答案),共11页。
人教版高考化学一轮总复习第9章第2节水的电离和溶液的pH课时学案: 这是一份人教版高考化学一轮总复习第9章第2节水的电离和溶液的pH课时学案,共35页。












