






人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素示范课课件ppt
展开
这是一份人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素示范课课件ppt,共28页。PPT课件主要包含了恢复蓝色,KOH合理即可,氧化性更强,5继续实验等内容,欢迎下载使用。
实验目的1.认识浓度、温度等因素对化学平衡的影响。2.进一步学习控制变量、对比等科学方法。
实验用品小烧杯、大烧杯、量筒、试管、试管架、玻璃棒、胶头滴管、酒精灯、火柴、两个封装有NO2和N2O4混合气体的圆底烧瓶。铁粉、0.05 ml·L-1 FeCl3溶液、0.15 ml·L-1 KSCN溶液、0.1 ml·L-1 K2Cr2O7溶液、6 ml·L-1 NaOH溶液、6 ml·L-1 H2SO4溶液、0.5 ml·L-1 CuCl2溶液、热水、冰块、蒸馏水。
实验步骤一、浓度对化学平衡的影响1.FeCl3溶液与KSCN溶液的反应(1)在小烧杯中加入10 mL蒸馏水,再滴入5滴0.05 ml·L-1 FeCl3溶液、5滴0.15 ml·L-1 KSCN溶液,用玻璃棒搅拌,使其充分混合,将混合均匀的溶液平均注入a、b、c三支试管中。
(2)向试管a中滴入5滴0.05 ml·L-1 FeCl3溶液, 向试管b中滴入5滴0.15 ml·L-1 KSCN溶液,观察并记录实验现象,与试管c进行对比。完成下表。
(3)继续向上述两支试管中分别加入少量铁粉,观察并记录实验现象。完成下表。
2.在K2Cr2O7溶液中存在如下平衡:取一支试管,加入2 mL 0.1 ml·L-1 K2Cr2O7溶液,然后按下表中的步骤进行实验,观察溶液颜色的变化,判断平衡是否发生移动及移动的方向。完成下表。
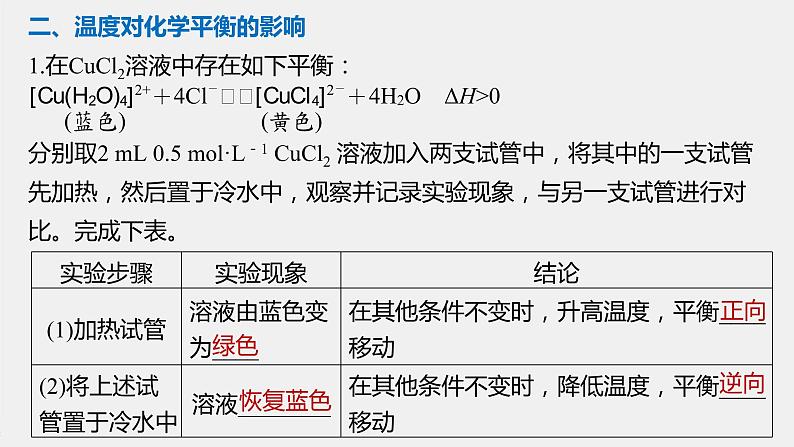
二、温度对化学平衡的影响1.在CuCl2溶液中存在如下平衡:分别取2 mL 0.5 ml·L-1 CuCl2 溶液加入两支试管中,将其中的一支试管先加热,然后置于冷水中,观察并记录实验现象,与另一支试管进行对比。完成下表。
2.取两个封装有NO2和N2O4混合气体的圆底烧瓶(编号分别为1和2),将它们分别浸在盛有热水、冷水的大烧杯中,比较两个烧瓶里气体的颜色。将两个烧瓶互换位置,稍等片刻,再比较两个烧瓶里气体的颜色。完成下表(2NO2 N2O4 ΔH<0):
问题和讨论1.在进行浓度、温度对化学平衡影响的实验时,应注意哪些问题?
答案 注意控制变量法的运用,在研究温度对平衡移动的影响时,只能改变温度这一个条件,其他条件保持一致。还要注意对比法的运用。
2.结合实验内容,尝试归纳影响化学平衡移动的因素。
答案 浓度改变:增加反应物的浓度,减少生成物的浓度,平衡向正反应方向移动;减少反应物的浓度,增加生成物的浓度,平衡向逆反应方向移动。 温度改变:升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动。
3.在对CuCl2溶液加热时,你是否观察到了[CuCl4]2-的黄色?你能说出原因吗?
答案 在对CuCl2溶液加热时,不能观察到[CuCl4]2-的黄色,因为加热时,平衡正向移动,[Cu(H2O)4]2+有部分转化为[CuCl4]2-,[Cu(H2O)4]2+显蓝色,[CuCl4]2-显黄色,而二者的混合色为绿色,所以看不到黄色。
1.下列实验、现象及结论都正确的是
解析 A选项加入KCl溶液,红色变浅;B选项所用的FeCl3溶液和CuSO4溶液的浓度不一致,且浓度大的FeCl3溶液的催化效果好,所以无法比较;C选项在室温下混合后就开始反应,所以无法准确观察温度的影响。
2.下列图中的实验方案,能达到实验目的的是
解析 将NO2球分别浸泡在冰水、热水中,根据颜色判断平衡移动的方向,故A正确;实验改变了温度、催化剂两个变量,不能验证FeCl3对H2O2分解反应有催化作用,故B错误;碳酸钠溶液与二氧化碳、二氧化硫都能反应,不能用饱和碳酸钠溶液除去CO2气体中混有的SO2,故C错误;氯化氢易挥发,氯化氢能与硅酸钠溶液反应生成硅酸沉淀,不能根据图示装置比较H2CO3和H2SiO3的酸性强弱,故D错误。
3.某同学利用如图1装置探究温度对化学平衡的影响,已知烧瓶中存在如下平衡:2NO2(g) N2O4(g) ΔH<0,当进行图2实验后,以下结论正确的是A.图2中,B烧瓶颜色较深B.图2中,B烧瓶与A烧瓶相比有 较多的NO2C.图2中B烧瓶的正反应速率比图1中B烧瓶的快D.图2中A烧瓶的正反应速率比图1中A烧瓶的快
下列说法不正确的是A.从实验数据分析,该反应的正反应是吸热反应B.实验①中,在0~10 min内,以v(H2)表示的反应速率大于0.013 ml·L-1·min-1C.从生产效益分析,③组实验的条件最佳D.比较实验②③,说明③实验使用了更高效的催化剂
解析 根据实验组②和③,升高温度,CO2的物质的量减少,说明升高温度,平衡向逆反应方向移动,即正反应是放热反应,故A错误;达到平衡时,v(CO2)= ml·L-1·min-1=0.13 ml·L-1·min-1,化学反应速率之比等于化学计量数之比,即v(H2)=c(CO2)=0.013 ml·L-1·min-1,随着反应的进行,反应物的浓度减小,化学反应速率降低,0~10 min内,v(H2)>0.013 ml·L-1·min-1,故B正确;根据表格数据,实验③温度低,投入量少,达到平衡时间短,因此从生产效益分析,③组实验的条件最佳,故C正确;实验②的温度高于③的温度,但达到平衡时间相等,说明③使用了比较高效的催化剂,故D正确。
5.某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。已知:①K2Cr2O7溶液存在平衡:
(1)ⅰ可证明反应 +H2O 2 +2H+的正反应是_____(填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_______________。
解析 “只降低生成物的浓度,该平衡正向移动”,则需要加入的试剂a必须是可以和产物离子如氢离子反应的物质,可以是氢氧化钾或是碳酸钾等。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的____(填“能”或“不能”),理由是________________________________________________________________________________________________________________。
浓硫酸溶于水放出大量的热,平衡会逆向移动,所以溶液橙色加深,不能说明是由于氢离子浓度的增大使平衡逆向移动的
解析 加入浓硫酸,不仅有增加氢离子浓度平衡逆向移动的情况,同时应考虑浓硫酸溶于水放出大量的热的情况,浓硫酸溶于水放出大量的热,平衡也会逆向移动。
(4)根据实验Ⅱ中不同现象,可以得出的结论是__________________________________。
在酸性条件下,K2Cr2O7的
解析 重铬酸钾具有氧化性,是重铬酸根离子的氧化性,根据实验中不同现象知道在酸性条件下,会增加重铬酸根离子的浓度。
①解释溶液变黄的主要原因是_________________________________________________________________________________________________________________________。
+2H+,亚硫酸根离子可以和氢离子结合,降低氢离子浓度,平衡正向移动,溶液变为黄色
②溶液变绿色,该反应的离子方程式是__________________________________________________。
相关课件
这是一份高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素图片课件ppt,共25页。
这是一份高中化学实验活动1 探究影响化学平衡移动的因素精品课件ppt,共16页。PPT课件主要包含了知识梳理,实验探究,实验反思,随堂检测等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素优质教学ppt课件,文件包含《实验活动1探究影响化学平衡移动的因素》课件pptx、《实验活动1探究影响化学平衡移动的因素》教学设计docx等2份课件配套教学资源,其中PPT共17页, 欢迎下载使用。









