





人教版 (2019)选择性必修1第四节 沉淀溶解平衡图文课件ppt
展开1.变化观念与平衡思想:知道难溶电解质的沉淀溶解平衡及其影响 因素,能多角度、动态地分析难溶电解质的溶解平衡。2.证据推理与模型认知:知道溶度积的意义,建立根据溶度积和离 子积的大小关系判断反应进行方向的思维模型。
一、难溶电解质的沉淀溶解平衡
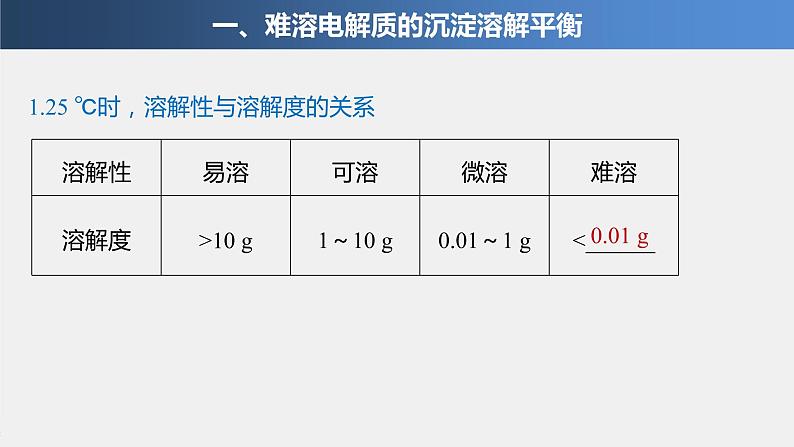
1.25 ℃时,溶解性与溶解度的关系
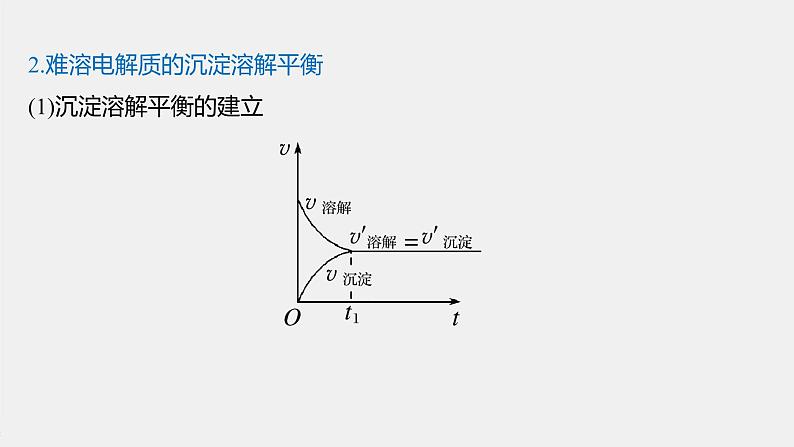
2.难溶电解质的沉淀溶解平衡(1)沉淀溶解平衡的建立
(2)沉淀溶解平衡方程式以AgCl沉淀溶解平衡为例:___________________________。特别提醒 沉淀溶解平衡方程式各物质要标明聚集状态。
(3)沉淀、溶解之间这种 平衡也决定了Ag+与Cl-的反应 进行到底。一般情况下,当溶液中剩余离子的浓度小于 时,化学上通常认为生成沉淀的反应进行 了。
1×10-5 ml·L-1
3.难溶电解质沉淀溶解平衡的影响因素(1)内因(决定因素):难溶电解质本身的性质。(2)外因:温度、浓度等条件的影响符合勒夏特列原理。(3)实例分析
特别提醒 大多数电解质溶解度随温度的升高而增大,但有许多例外,如Ca(OH)2,温度越高,溶解度越小。
(4)含等物质的量的AgNO3与NaCl的溶液混合后,恰好完全生成AgCl沉淀,溶液中不存在Ag+和Cl-( )(5)当溶液中某离子浓度小于1×10-5 ml·L-1时,可视为该离子沉淀完全( )
(2)难溶电解质的沉淀溶解平衡是动态平衡,即溶解和沉淀仍然同时进行着,只是v(溶解)=v(沉淀)( )
A.恒温下向溶液中加入CaO,溶液的pH升高B.给溶液加热,溶液的pH升高C.向溶液中加入Na2CO3溶液,其中固体质量增加D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
解析 恒温下加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH不变,A错误;加热,Ca(OH)2的溶解度减小,溶液的pH降低,B错误;加入Na2CO3溶液,沉淀溶解平衡向右移动,Ca(OH)2固体转化为CaCO3固体,固体质量增加,C正确;加入NaOH固体平衡向左移动,Ca(OH)2固体质量增加,D错误。
2.将AgCl分别投入下列溶液中:①40 mL 0.03 ml·L-1的HCl溶液 ②50 mL 0.03 ml·L-1的AgNO3溶液 ③30 mL 0.02 ml·L-1的CaCl2溶液 ④10 mL蒸馏水。AgCl的溶解度由大到小的顺序是 ______ 。
②中c(Ag+)=0.03 ml·L-1,也抑制了AgCl(s)的溶解,且抑制程度与①相同;③中的c(Cl-)=0.04 ml·L-1,抑制溶解,且抑制程度大于①和②,AgCl(s)的溶解度更小。所以AgCl的溶解度由大到小的顺序是④>①=②>③。
难溶电解质沉淀溶解平衡与其电离平衡的区别
1.概念难溶电解质的沉淀溶解 称为 ,简称溶度积,符号为 ,Ksp的大小反映难溶电解质在水中的溶解能力。2.表达式
Ksp= 。
cm(An+)·cn(Bm-)
Ksp=c(Fe3+)·c3(OH-)。
3.影响因素溶度积Ksp值的大小只与 的性质和 有关。4.应用定量判断给定条件下有无沉淀生成。
(1)Q>Ksp,溶液过饱和,有 析出,直至溶液 ,达到新的平衡。(2)Q=Ksp,溶液饱和,沉淀与溶解处于 。(3)Q
易错警示 同种类型的难溶电解质,Ksp可用于溶解度的直接比较,如AgCl、AgBr、AgI都是AB型,Ag2S是A2B型,不同类型不能直接比较溶解度大小。
已知25 ℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。(1)25 ℃时,氯化银的饱和溶液中,c(Cl-)= ,向其中加入NaCl固体,溶解平衡 ,溶度积常数 。
1.3×10-5ml·L-1
(2)25 ℃时,若向50 mL 0.018 ml·L-1的AgNO3溶液中加入50 mL 0.020 ml·L-1的盐酸,混合后溶液中的c(Ag+)= ,pH= 。
1.8×10-7 ml·L-1
(3)25 ℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序为 ,由此可得出 更难溶。
Ag2CrO4>AgCl
解析 在Ag2CrO4的沉淀溶解平衡中
解析 AgCl和AgI同时沉淀时,溶液中的c(Ag+)一定是相同的,所以就有:
(5)将等体积的4×10-3 ml·L-1的AgNO3溶液和4×10-3 ml·L-1的K2CrO4溶液混合 (填“有”或“没有”)Ag2CrO4沉淀产生。
(1)Ksp只与难溶电解质的性质、温度有关,而与沉淀的量和溶液中离子浓度无关。(2)①Ksp反映了难溶电解质在水中的溶解能力。在相同温度时,对于同类型物质,Ksp数值越大,难溶电解质在水中的溶解能力越强。如由Ksp数值可知,溶解能力:AgCl>AgBr>AgI,Cu(OH)2
1.向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
A.2.0×10-29 B.3.2×10-12C.6.3×10-18 D.5.1×10-27
3.将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。下列溶液中Ba2+的浓度最小的是A.10 mL 0.2 ml·L-1 Na2CO3溶液B.40 mL 水C.50 mL 0.01 ml·L-1 BaCl2溶液D.100 mL 0.01 ml·L-1盐酸
C项,BaCl2电离产生的Ba2+的浓度为0.01 ml·L-1,虽然BaCO3的溶解受到抑制,但Ba2+的浓度仍较大;D项,BaCO3与盐酸反应生成Ba2+的浓度为0.005 ml·L-1,Ba2+的浓度较大。
4.(2019·肇庆高二检测)某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是A.Ksp[Cu(OH)2]
d点溶液中,c(Fe3+)大于该pH下达到沉淀溶解平衡的c(Fe3+),则Q>Ksp[Fe(OH)3],说明Fe(OH)3已过饱和,同理,c(Cu2+)小于该pH下达到沉淀溶解平衡的c(Cu2+),则Q
解析 Ksp=c(Cr3+)·c3(OH-)=10-32,
(2)在0.10 ml·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= ml·L-1(Ksp[Cu(OH)2]=2.2×10-20)。若在0.10 ml·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是 ml·L-1。
解析 pH=8时c(OH-)=10-6 ml·L-1,由氢氧化铜的溶度积常数可知:Ksp=2.2×10-20=10-12×c(Cu2+),得c(Cu2+)=2.2×10-8 ml·L-1;使Cu2+完全沉淀为CuS,已知c(Cu2+)=0.10 ml·L-1,根据反应关系式:Cu2+~2H+得c(H+)=0.20 ml·L-1。
题组一 沉淀溶解平衡的含义1.下列关于沉淀溶解平衡的说法正确的是A.只有难溶电解质才存在沉淀溶解平衡过程B.沉淀溶解平衡过程是可逆的C.在平衡状态时,v(溶解)=v(沉淀)=0D.达到沉淀溶解平衡的溶液不一定是饱和溶液
解析 无论是难溶电解质还是易溶电解质,都可存在沉淀溶解平衡过程,A项错误;沉淀溶解平衡过程是可逆的,B项正确;沉淀溶解达平衡状态时,v(溶解)=v(沉淀)≠0,C项错误;沉淀溶解过程达到平衡时,溶液达到饱和状态,D项错误。
2.下列有关AgCl的沉淀溶解平衡说法正确的是A.AgCl沉淀生成和沉淀溶解达平衡后不再进行B.AgCl难溶于水,溶液中没有Ag+和Cl-C.升高温度,AgCl沉淀的溶解度增大D.向AgCl沉淀溶解平衡体系中加入NaCl固体,AgCl沉淀的溶解度不变
解析 难溶物达到沉淀溶解平衡时沉淀的生成和溶解都不停止,但溶解速率和生成速率相等,A错误;没有绝对不溶的物质,B错误;温度越高,一般物质的溶解度越大,C正确;向AgCl沉淀溶解平衡体系中加入NaCl固体,使溶解平衡左移,AgCl的溶解度减小,D错误。
题组二 外界条件对沉淀溶解平衡的影响3.在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是A.加MgSO4固体 B.加HCl溶液C.加NaOH固体 D.加少量水
4.在AgCl、CaCO3、Fe(OH)3、Mg(OH)2这些物质中,溶解度不随pH变化的是A.AgCl B.CaCO3C.Fe(OH)3 D.Mg(OH)2
解析 pH变小,酸性增强,H+会与溶解出的OH-、 反应,从而促进溶解。
A.溶液中Pb2+和I-浓度都增大B.溶度积常数Ksp增大C.沉淀溶解平衡向右移动D.溶液中Pb2+浓度减小
解析 加入KI溶液时,溶液中c(I-)增大,使PbI2的沉淀溶解平衡逆向移动,因此溶液中c(Pb2+)减小,但由于溶液温度未发生改变,故PbI2的溶度积常数Ksp不发生变化。
6.(2020·渝北高二检测)一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是①20 mL 0.01 ml·L-1 KCl溶液 ②30 mL 0.02 ml·L-1 CaCl2溶液 ③40 mL 0.03 ml·L-1 HCl溶液 ④10 mL 蒸馏水 ⑤50 mL 0.05 ml·L-1 AgNO3溶液A.①>②>③>④>⑤ B.④>①>③>②>⑤C.⑤>④>②>①>③ D.④>③>⑤>②>①
解析 AgCl(s) Ag+(aq)+Cl-(aq),c(Cl-)或c(Ag+)越大,对AgCl的溶解抑制作用越大,AgCl的溶解度就越小。注意AgCl的溶解度大小只与溶液中Ag+或Cl-的浓度有关,而与溶液体积无关。①c(Cl-)=0.01 ml·L-1,②c(Cl-)=0.04 ml·L-1,③c(Cl-)=0.03 ml·L-1,④c(Cl-)=0 ml·L-1,⑤c(Ag+)=0.05 ml·L-1;Ag+或Cl-浓度由小到大的顺序为④<①<③<②<⑤,故AgCl的溶解度由大到小的排列顺序为④>①>③>②>⑤。
题组三 溶度积及应用7.(2020·郑州期中)下列说法正确的是A.难溶电解质在水中达到沉淀溶解平衡时,沉淀和溶解立即停止B.Ksp越小,难溶电解质在水中的溶解能力一定越弱C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的溶解能力相同
解析 难溶电解质在水中达到沉淀溶解平衡,沉淀溶解平衡是动态平衡,沉淀和溶解的速率相同,故A项错误;Ksp可用来判断相同类型的化合物在水中的溶解度大小,但如果化合物的类型不同,就不能直接进行判断,故B项错误;Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关,故C项正确;相同温度下,AgCl在水中的溶解能力大于在NaCl溶液中的溶解能力,因为在NaCl溶液中氯离子对氯化银的溶解起到抑制作用,故D项错误。
8.下列说法正确的是A.含有AgCl和AgI固体的悬浊液中c(Ag+)>c(Cl-)=c(I-)B.25 ℃时,Cu(OH)2在水中的溶解度大于在Cu(NO3)2溶液中的溶解度C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大D.25 ℃时,AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
解析 Ksp(AgCl)>Ksp(AgI),所以含AgCl和AgI固体的悬浊液中c(Ag+)>c(Cl-)>c(I-),A项不正确;
溶液中c(Cl-)越大,AgCl的溶解度越小,D项不正确。
9.在100 mL 0.01 ml·L-1 KCl溶液中,加入1 mL 0.01 ml·L-1 AgNO3溶液,下列说法正确的是(AgCl的Ksp=1.8×10-10)A.有AgCl沉淀析出B.无AgCl沉淀析出C.无法确定是否有AgCl沉淀析出D.有沉淀析出,但不是AgCl沉淀
10.已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 ml·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于A.2.8×10-2 ml·L-1B.1.4×10-5 ml·L-1C.2.8×10-5 ml·L-1D.5.6×10-5 ml·L-1
11.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是A.AgCl>AgI>Ag2CrO4B.AgCl>Ag2CrO4>AgIC.Ag2CrO4>AgCl>AgID.Ag2CrO4>AgI>AgCl
解析 由Ksp(AgCl)=1.8×10-10可求出c(Ag+)≈1.34×10-5 ml·L-1;由Ksp(AgI)=8.5×10-17可求出c(Ag+)≈0.92×10-8 ml·L-1;由Ksp(Ag2CrO4)=2.0×10-12可求出c(Ag+)≈1.59×10-4 ml·L-1,所以c(Ag+)大小顺序为Ag2CrO4>AgCl>AgI。
12.已知:pAg=-lg c(Ag+),Ksp(AgCl)=1.8×10-10。如图是向10 mL AgNO3溶液中逐滴加入0.1 ml·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是A.原AgNO3溶液的物质的量浓度为0.1 ml·L-1B.图中x点的坐标为(100,6)C.图中x点表示溶液中Ag+被恰好完全沉淀(浓度为0)D.若把0.1 ml·L-1 NaCl溶液换成0.1 ml·L-1 NaI溶 液,则图像在终点后变为虚线部分
解析 加入NaCl之前,pAg=0,所以c(AgNO3)=1 ml·L-1,A错误;
若把NaCl换成NaI,由于Ksp(AgI)更小,所以c(Ag+)更小,pAg更大,与图像不符,D错误。
13.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是A.加入Na2SO4可以使溶液由a点变到b点B.通过蒸发可以使溶液由d点变到c点C.d点无BaSO4沉淀生成D.a点对应的Ksp大于c点对应的Ksp
解析 A项,温度不变,加入Na2SO4会导致沉淀溶解平衡向左移动,但两离子浓度的乘积仍不变,仍在曲线上,不会由a点变到b点;
C项,d点还没有形成饱和溶液,因此无BaSO4沉淀生成;D项,a点与c点的Ksp相等。
14.室温下用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为 ,加碱调节至pH为___时,铁离子刚好沉淀完全(离子浓度小于1×10-5 ml·L-1时,即可认为该离子沉淀完全);继续加碱至pH为 时,锌开始沉淀(假定Zn2+浓度为0.1 ml·L-1)。若上述过程不加H2O2后果是___________________,原因是 。已知:
Zn2+和Fe2+不能分离
Fe(OH)2和Zn(OH)2的Ksp相近
15.根据题目提供的溶度积数据进行计算并回答下列问题:(1)在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c( )=10-3 ml·L-1,则Ca2+是否沉淀完全? (填“是”或“否”)。[已知c(Ca2+)≤10-5 ml·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(2)25 ℃时,Mg(OH)2饱和溶液___(填“能”或“不能”)使石蕊溶液变蓝色。(已知Ksp[Mg(OH)2]=4.0×10-12,lg5=0.7)
(3)大量的碘富集在海藻中,用水浸取后浓缩,该浓缩液中主要含有I-、Cl-等离子。取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 为 。[已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17]
(4)在Cl-和 浓度都是0.100 ml·L-1的混合溶液中逐滴加入AgNO3溶液(忽略体积改变)时,AgCl和Ag2CrO4中 先沉淀,当Ag2CrO4开始沉淀时,溶液中c(Cl-)= ml·L-1。[Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12]
因此,AgCl先沉淀。当Ag2CrO4开始沉淀时:c(Ag+)=9.5×10-6 ml·L-1,
人教版 (2019)选择性必修1第四节 沉淀溶解平衡背景图ppt课件: 这是一份人教版 (2019)选择性必修1第四节 沉淀溶解平衡背景图ppt课件,共15页。
高中人教版 (2019)第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡精品ppt课件: 这是一份高中人教版 (2019)第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡精品ppt课件,共34页。PPT课件主要包含了温故知新,什么是饱和溶液,饱和NaCl溶液,思考得到什么启示,思考与讨论,离子浓度,随堂一练,溶度积常数等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡优秀课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡优秀课件ppt,文件包含高中化学新教材同步选择性必修第1册第21讲沉淀溶解平衡一难溶电解质的沉淀溶解平衡PPT课件pptx、高中化学新教材同步选择性必修第1册第21讲沉淀溶解平衡一难溶电解质的沉淀溶解平衡教师版docx、高中化学新教材同步选择性必修第1册第21讲沉淀溶解平衡一难溶电解质的沉淀溶解平衡学生版docx等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。













