




科粤版九年级下册6.2 金属的化学性质集体备课课件ppt
展开
这是一份科粤版九年级下册6.2 金属的化学性质集体备课课件ppt,共15页。PPT课件主要包含了金属与氧气的反应,金属的化学性质,活泼程度,ZnFe,MgZnFe,没有明显变化,金属活动性由强减弱,金属活动性顺序,不是氢气,钾最强等内容,欢迎下载使用。
Mg +O2 === Al + O2 === Fe + O2 === Cu + O2 ===
Mg>Al、Fe>Cu
1、判断金属活动性的方法一: 根据金属与氧气反应的难易程度与反应现象的剧烈程度判断
2、大多数金属都能与氧气发生反应
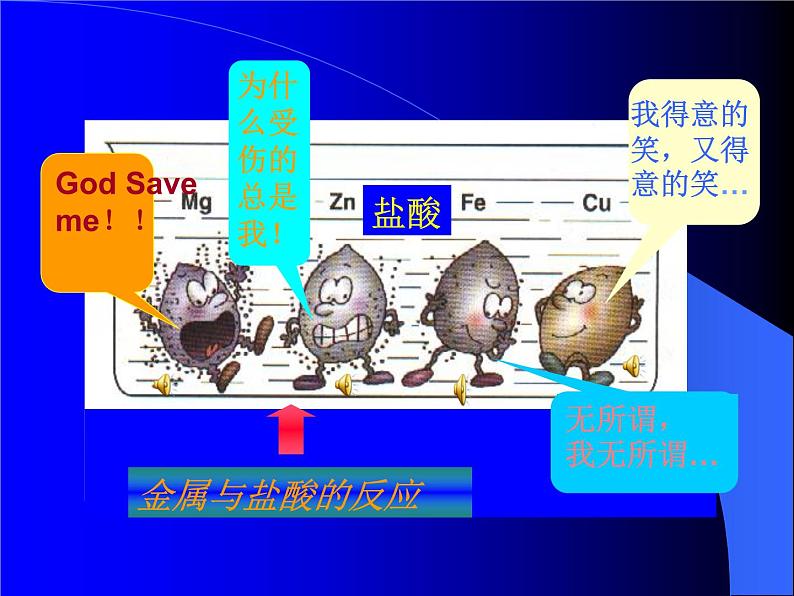
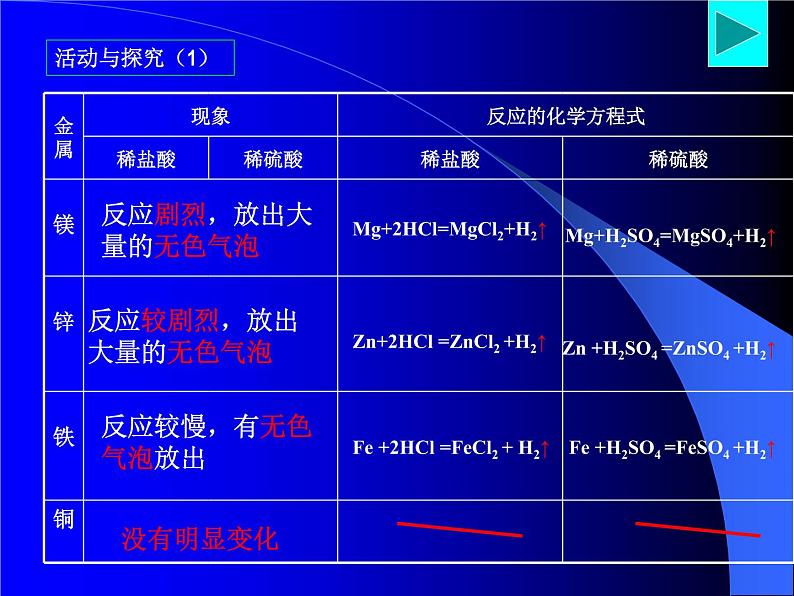
探究目的:比较镁、铁、铜、锌四种金属的活泼程度你的假设是:实验内容:将盐酸(或稀硫酸)加入四支试管中,观察观察注意:1、金属与酸能否反应 (1)可与盐酸、稀硫酸反应的金属有: (2)不与盐酸、稀硫酸反应的金属有: 2、若能反应,请比较各金属反应的剧烈程度 剧烈程度从大到小为: 3、反应中,伴随着的现象是:你的结论是:
活泼程度:Mg>Zn>Fe> Cu
反应剧烈,放出大量的无色气泡
反应较剧烈,放出大量的无色气泡
反应较慢,有无色气泡放出
Mg+2HCl=MgCl2+H2↑
Zn+2HCl =ZnCl2 +H2↑
Fe +2HCl =FeCl2 + H2↑
Mg+H2SO4=MgSO4+H2↑
Zn +H2SO4 =ZnSO4 +H2↑
Fe +H2SO4 =FeSO4 +H2↑
1、大多数金属能与稀盐酸或稀硫酸反应; 2、可根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断金属的活动性强弱;
铁丝表面有红色的固体析出
铜丝表面有白色的固体析出
Fe+CuSO4=FeSO4+Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金
判断的依据:1、在金属活动性顺序里,位置越前,它的活动性越强。2、在金属活动性顺序里,位于氢前的金属能置换出盐酸、 稀硫酸中的氢。3、在金属活动性顺序里,位于前面的金属能把后面的金 属从它们化合物的溶液里置换出来。
(K、Ca、Na三种金属除外)
一、金属的化学性质:1、与氧气反应(金属越活泼,反应越容易,越剧烈)2、氢前金属+盐酸(稀硫酸)(置换反应)(金属越活泼,反应越容易,越剧烈)3、位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来。二、金属活动顺序及其应用(判断金属能否在溶液中发生置换反应,及反应的快慢)
1. X、Y、Z是三种金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )①Z+YSO4==ZSO4+Y ②X+ YSO4==XSO4+Y③X+ H2SO4== XSO4+ H2 ↑ ④Z+ H2SO4不反应 A、Z>X>Y B、Z>Y>X C、X>Y>Z D、X>Z>Y
2、下列物质能否发生反应?写出能发生反应的化学方程式。(1)银与稀盐酸(2)铁与硫酸铜溶液(3)铜与硫酸锌溶液(4)铝与硝酸银溶液
3 、设计一个实验方案,鉴别真假黄金。
相关课件
这是一份科粤版九年级下册6.2 金属的化学性质课文配套ppt课件,共15页。PPT课件主要包含了学习目标,新知学习,铝和硫酸铜溶液,铁和硫酸铜溶液,铜和硫酸铝溶液,交流讨论,金属活动性顺序,药品操作判断,当堂检测等内容,欢迎下载使用。
这是一份化学第六章 金属6.2 金属的化学性质背景图课件ppt,共31页。PPT课件主要包含了MgFe,MgCu,置换反应,学完本课题你应该知道,化学方程式,课堂练习等内容,欢迎下载使用。
这是一份科粤版九年级下册6.2 金属的化学性质背景图课件ppt,共30页。PPT课件主要包含了铁与氧气反应,铜与氧气反应,人民电影院,金与氧气不反应,常温和高温下都不反应,置换反应,金属活动性由强减弱,反应现象无变化,金属活动性顺序表,课堂小结等内容,欢迎下载使用。










