

所属成套资源:江苏省淮安市车桥中学2022届高三上学期入学调研(A)各科试题+Word版含答案
江苏省淮安市车桥中学2022届高三上学期入学调研(A)化学试题Word版含答案
展开
这是一份江苏省淮安市车桥中学2022届高三上学期入学调研(A)化学试题Word版含答案,共21页。试卷主要包含了选择题的作答,非选择题的作答,维生素C的结构简式如图所示,自然界中时刻存在着氮气的转化等内容,欢迎下载使用。
化 学 (A)
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
一、选择题。
1.下列说法不正确的是
A.“中国天眼”的球面射电板由铝合金板制成,铝合金比纯铝的熔点低、硬度大
B.石墨烯和碳纳米管为同素异形体,均为无机非金属材料
C.“天问一号”火星探测器,其太阳能电池板的主要材料是硅
D.给动力不足的新能源汽车充电不涉及氧化还原反应
【答案】D
【解析】A.合金的硬度一般比成分金属大,熔点比成分金属低,故“中国天眼”的球面射电板由铝合金板制成,铝合金比纯铝的熔点低、硬度大,A正确;B.石墨烯和碳纳米管是碳元素的不同性质的单质,二者为同素异形体,均为无机非金属材料,B正确;C.Si单质导电性介于导体与绝缘体之间,是良好的半导体材料。“天问一号”火星探测器,其太阳能电池板的主要材料是晶体硅,C正确;D.给动力不足的新能源汽车充电时,阳极发生氧化反应,阴极发生还原反应,因此涉及反应类型为氧化还原反应,D错误。
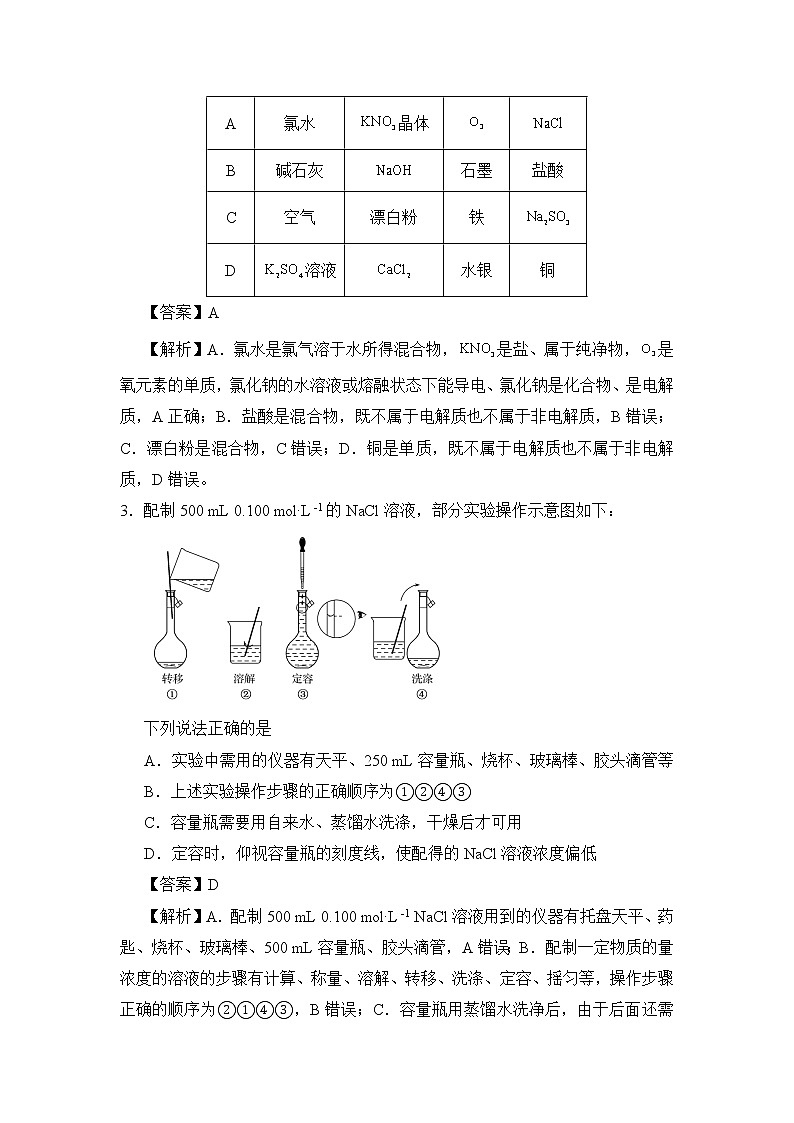
2.下列物质分类组合正确的是
【答案】A
【解析】A.氯水是氯气溶于水所得混合物,是盐、属于纯净物,是氧元素的单质,氯化钠的水溶液或熔融状态下能导电、氯化钠是化合物、是电解质,A正确;B.盐酸是混合物,既不属于电解质也不属于非电解质,B错误;C.漂白粉是混合物,C错误;D.铜是单质,既不属于电解质也不属于非电解质,D错误。
3.配制500 mL 0.100 ml·L-1的NaCl溶液,部分实验操作示意图如下:
下列说法正确的是
A.实验中需用的仪器有天平、250 mL容量瓶、烧杯、玻璃棒、胶头滴管等
B.上述实验操作步骤的正确顺序为①②④③
C.容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
【答案】D
【解析】A.配制500 mL 0.100 ml·L-1 NaCl溶液用到的仪器有托盘天平、药匙、烧杯、玻璃棒、500 mL容量瓶、胶头滴管,A错误;B.配制一定物质的量浓度的溶液的步骤有计算、称量、溶解、转移、洗涤、定容、摇匀等,操作步骤正确的顺序为②①④③,B错误;C.容量瓶用蒸馏水洗净后,由于后面还需要加入蒸馏水定容,所以不必干燥,C错误;D.定容时仰视容量瓶的刻度线,则所加蒸馏水偏多,溶液的体积V偏大,溶液的浓度偏低,D正确。
4.设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 ml H2C2O4与足量酸性KMnO4溶液充分反应,转移电子数为0.1NA
B.标准状况下,5.6 L F2和C2H6的混合物中含有电子的数目为4.5NA
C.标准状况下,11.2 L三氯甲烷中含有氯原子的数目为1.5NA
D.标准状况下,CH4与2.24 LCl2恰好完全反应,生成物中气体分子的数目为0.2NA
【答案】B
【解析】A.H2C2O4与足量酸性KMnO4溶液充分反应后变为CO2气体,1 mlH2C2O4充分反应转移2 ml电子,则0.1 ml H2C2O4与足量酸性KMnO4溶液充分反应,转移电子数为0.2NA,A错误;B.F2和C2H6的分子中都含有18个电子,标准状况下,5.6 L F2和C2H6的混合物的物质的量是0.25 ml,则其中含有电子的数目为0.25 ml ×18NA=4.5NA,B正确;C.标准状况下三氯甲烷呈液态,不能使用气体摩尔体积进行计算,C错误;D.在标准状况下2.24 LCl2的物质的量是0.1 ml,0.1 ml Cl2与CH4反应,首先反应产生气体CH3Cl、HCl,反应产生的CH3Cl会进一步与Cl2发生取代反应产生液态CH2Cl2、CHCl3、CCl4,取代反应产生的CH2Cl2、CHCl3、CCl4都呈液态,因此上述反应完全进行后,生成物中气体分子的数目小于0.2NA,D错误。
5.下列指定反应的离子方程式不正确的是
A.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=Cu
B.氨水与稀盐酸反应:NH3•H2O+H+=NH+H2O
C.用过量NaOH溶液脱除烟气中的SO2:OH-+SO2=HSO
D.饱和Na2CO3溶液与CaSO4固体反应:CO(aq)+CaSO4(s)CaCO3(s)+SO(aq)
【答案】C
【解析】A.电镀Cu时,阴极Cu2+得电子生成Cu,电极反应为Cu2++2e-=Cu,A正确;B.氨水与稀盐酸反应生成NH4Cl和H2O,离子方程式为NH3•H2O+H+=NH+H2O,B正确;C.过量NaOH与SO2反应生成Na2SO3和H2O,离子方程式为2OH-+SO2=SO+2H2O,C错误;D.饱和Na2CO3溶液与CaSO4固体反应生成更难溶于水的CaCO3,离子方程式CO(aq)+CaSO4(s)CaCO3(s)+SO(aq),D正确。
6.工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
下列说法错误的是
A.过程①属于氮的固定
B.氮气在足量氧气中也可以通过一步反应生成NO2
C.过程④反应中氧化剂与还原剂的物质的量之比为1:2
D.常温下可用铁质容器储存浓硝酸
【答案】B
【解析】A.过程①是氮气和氢气高温高压催化剂作用下反应生成氨气,属于氮的固定,故A正确;B.氮气在足量氧气中可以通过一步反应生成NO,不能生成NO2,故B错误;C.过程④3NO2+H2O=2HNO3+NO,反应中氧化剂与还原剂的物质的量之比为1:2,故C正确;D.铁在浓硝酸中发生钝化,金属表面生成一薄层致密氧化物薄膜,阻止内部反应继续进行,常温下可用铁质容器储存浓硝酸,故D正确;故选B。
7.维生素C的结构简式如图所示。关于维生素C的说法正确的是
A.分子式为B.能使溴水褪色
C.分子中所有原子可能共面D.最多能与发生加成反应
【答案】B
【解析】A.分子式为,错误;B.维生素C中含有碳碳双键,能使溴水褪色,正确;C.分子中含有-CH2-原子团,所有原子不可能共面,错误;D.分子中只有碳碳双键能和氢气加成,酯基不能与氢气加成,故最多能与发生加成反应,错误;故选B。
8.某些氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO4、2Na2O2+2SO3(g)= 2Na2SO4+O2。据此判断下列反应方程式错误的是
A.2Na2O2+2N2O3=4NaNO2+O2B.Na2O2+2NO2=2NaNO3
C.2Na2O2+2N2O5═4NaNO3+O2D.2Na2O2+2Mn2O7=4NaMnO4+O2
【答案】A
【解析】由题给信息可知,过氧化钠与最高价态的氧化物反应生成对应的盐和氧气,过氧化钠具有强氧化性,与不是最高价态的氧化物反应生成其最高价的盐,没有氧气生成。A.三氧化二氮中氮元素不是最高价态,由分析可知,与过氧化钠反应生成硝酸钠,不能生成亚硝酸钠和氧气,故A错误;B.二氧化氮中氮元素不是最高价态,由分析可知,与过氧化钠反应生成硝酸钠,故B正确;C.五氧化二氮中氮元素是最高价态,由分析可知,与过氧化钠反应生成硝酸钠和氧气,故C正确;D.七氧化二锰中锰元素是最高价态,由分析可知,与过氧化钠反应生成高锰酸钠和氧气,故D正确;故选A。
9.自然界中时刻存在着氮气的转化。实现氮气按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图。下列叙述正确的是
A.N2→NH3,NH3→NO均属于氮的固定
B.在催化剂a作用下,N2发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
【答案】D
【解析】A.氮的固定是指氮由游离态转变为化合态,N2→NH3的反应为氮的固定,但NH3→NO的反应没有氮气参与,不属于氮的固定,故A错误;B.由示意图可知,在催化剂a作用下,氮元素化合价降低被还原,氮气发生还原反应,故B错误;C.由示意图可知,催化剂a的表面只发生了非极性共价键的断裂,没有发生极性共价键的断裂,故C错误;D.使用催化剂a、b可加快反应速率,能提高单位时间内生成物的产量,故D正确;故答案为D。
10.下列关于铝单质的叙述中,正确的是
A.铝和NaOH溶液反应:Al+2OH-+2H2O=[Al(OH)4]-+H2↑
B.铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定
C.不能用铝制的器皿来盛放酸梅汤或碱水是因为铝会和酸或碱反应
D.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝会滴落下来,是因为金属铝的熔点较低
【答案】C
【解析】A.电荷、电子均不守恒,正确的离子方程式为2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑,A项错误;B.铝制品在空气,其表面形成致密的氧化膜,铝的化学性质不稳定,B项错误;
C.无论是铝还是其氧化物都能与酸或碱反应,C项正确;D.打磨后的铝箔在酒精灯上灼烧表面生成Al2O3,高熔点的Al2O3兜住了熔融的液态铝,不会滴落,D项错误。
11.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
A.AB.BC.CD.D
【答案】A
【解析】A.纯碱是碳酸钠,可看成是氢氧化钠和碳酸反应得到,属于强碱弱酸盐。,存在水解平衡,溶液显碱性,可用来清洗油污(油脂在碱性环境发生水解反应),故A正确; B.不锈钢是合金,化学性质稳定,在潮湿环境不易被腐蚀,故B错误;C.Fe2O3为红棕色,可用作红色油漆和涂料,与Fe2O3是碱性氧化物无关,故C错误;D.铜与浓硝酸发生反应生成NO2,红棕色只是NO2的物理性质,与制取方式无关,故D错误;故答案为A。
12.根据下列实验操作和现象所得出的结论正确的是
A.AB.BC.CD.D
【答案】D
【解析】A.向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色,也可能是氯化铁溶液,故A错误;B.浓盐酸具有挥发性,也能与硅酸钠反应,故B错误;C.向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液变黄,无法确定双氧水和硝酸谁是氧化剂,故C错误;D.取5mL0.1ml·L-1KI溶液,加入1mL0.1ml·L-1FeCl3溶液,2Fe3+ + 2I -=2Fe2+ + I2,氯化铁不足,由现象可知,铁离子不能完全转化,说明该反应为可逆反应,故D正确。
13.某固体混合物X,含有Al2(SO4)3、FeCl3、Na2CO3和CuSO4中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与NaOH溶液作用,无变化。
下列说法不正确的是
A.混合物X中必定含有Na2CO3,不含Al2(SO4)3
B.溶液Z中溶质主要是钠盐,且必含NaHCO3
C.灼烧沉淀Y,可以得到黑色物质
D.往溶液Z中加入Cu粉,若不溶解,说明X中不含FeCl3
【答案】D
【解析】由固体混合物X与水作用有气泡冒出可知,X中一定含有Na2CO3,由得到有色沉淀Y和弱碱性溶液Z,沉淀Y与NaOH溶液作用无变化可知,X中一定不含有Al2(SO4)3,至少还有FeCl3和CuSO4中的一种或两种,Na2CO3在溶液中发生双水解反应生成二氧化碳和碳酸氢钠。
A.由分析可知,混合物X中必定含有Na2CO3,不含Al2(SO4)3,故A正确;
B.由分析可知,Na2CO3在溶液中发生双水解反应生成二氧化碳和碳酸氢钠,则溶液Z中溶质主要是钠盐,且必含NaHCO3,故B正确;C.沉淀Y可能为氢氧化铜,则灼烧氢氧化铜可以得到黑色氧化铜固体,故C正确;D.由分析可知,溶液Z中存在碳酸氢钠溶液,说明铁离子和铜离子与碳酸钠溶液完全反应,往溶液Z中加入Cu粉,铜粉一定不溶解,则依据铜粉不溶解无法判断X中是否含有氯化铁,故D错误。
14.已知NO2与N2O4可相互转化:2NO2(g)⇌N2O4(g) ΔH=-24.2kJ·ml-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示。下列推理分析合理的是
A.前10min内,用v(NO2)表示的反应速率为0.02ml·L-1·min-1
B.反应进行到10min时,体系吸收的热量为9.68kJ
C.a、b、c、d四点中v(正)与v(逆)均相等
D.25min时,正反应速率减小
【答案】B
【解析】在相同时间内,b、d所在的曲线物质的量浓度变化是a、c所在的曲线物质的量浓度变化的2倍,所以b、d表示NO2浓度的变化,a、c表示N2O4浓度的变化.。
A.前10min内,用v(NO2)表示的反应速率为0.04ml·L-1·min-1,故A错误;B.反应进行到10min时,反应共消耗N2O4的物质的量是0.2ml/L×2L=0.4ml,体系吸收的热量为24.2kJ·ml-1×0.4ml=9.68kJ,故B正确;C.a、b、c、d四点中,b、d两点反应达到平衡状态,v(正)=v(逆),a点反应逆向进行v(正)v(逆),故C错误;D.25min时,NO2浓度增大,正反应速率增大,故D错误;选B。
15.二氧化硫是一种大气污染物,可用氨水吸收处理。下图是实验室制取二氧化硫并验证其部分性质的装置,下列说法正确的是
A.使用品红溶液是用来验证SO2的还原性
B.K2Cr2O7溶液由橙红色变成绿色(生成Cr3+),氧化剂与还原剂的物质的量之比是3∶1
C.SO2的发生装置中,使用70%的浓硫酸既可以加快反应速率又有利于生成的SO2逸出
D.过量的氨水吸收SO2气体可以生成亚硫酸氢铵
【答案】C
【解析】A.SO2气体具有漂白性,能够使品红溶液褪色,因此使用品红溶液是用来验证SO2的漂白性,A错误;B.K2Cr2O7具有强的氧化性,会将SO2氧化为H2SO4,其本身被还原产生Cr3+,1 ml K2Cr2O7得到6 ml电子,1 ml SO2反应失去2 ml电子,则根据氧化还原反应中电子得失数目相等,可知氧化剂与还原剂的物质的量之比是1∶3,B错误;C.在SO2的发生装置中,使用70%的浓硫酸溶液中H+浓度大,既可以加快制取气体反应速率,同时又利用H2SO3是弱酸的性质,可以减少SO2气体在溶液中的溶解,有利于生成的SO2逸出,C正确;D.当氨水过量时,其吸收少量SO2气体,反应生成正盐亚硫酸铵;只有当SO2气体过量,氨水少量时二者反应才反应产生酸式盐亚硫酸氢铵,D错误。
16.室温下,用的NaOH溶液滴定的CH3COOH溶液,水电离出的随溶液体积的变化曲线如图所示。下列说法正确的是
A.P、M、N三点,M点最大
B.M点溶液显中性,
C.该滴定过程选择甲基橙作为指示剂
D.N点溶液中
【答案】D
【解析】A.P点未滴加NaOH溶液时,溶液显酸性,随着NaOH的滴入,溶液的酸性逐渐减弱,到M点时恰好完全反应产生CH3COONa,溶液显碱性,后随着NaOH的滴入,溶液的碱性逐渐增强,N点pH最大,A错误;B.M点时溶液中水电离程度最大,说明酸碱恰好完全中和产生CH3COONa,由于醋酸是一元酸、NaOH是一元碱,二者的浓度相等,因此二者恰好中和时的体积相等,故M点对应的NaOH溶液的体积为10.00mL,但是溶液显碱性,B错误;C.用NaOH溶液滴定醋酸,由于恰好完全反应时产生的醋酸钠是强碱弱酸盐,水解使溶液显碱性,因此要选择碱性范围内变色的指示剂误差较小,可选用酚酞作指示剂,不能选用甲基橙作指示剂,C错误;D.N点溶液为NaOH、CHCOONa的混合荣毅仁,根据电荷守恒可得,D正确。
二、非选择题。
17.溶液常用作氧化还原反应滴定的标准液,利用氧化制备的装置如图所示(加热、夹持装置略):
已知: K2MnO4在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
回答下列问题:
(1)K2MnO4的化学名称为_______。
(2)装置A中所发生反应的化学方程式为_______;其中a的作用是_______。
(3)装置C中盛装的试剂是_______。
(4)分析发现该装置有不足之处,改进的方法是_______。
(5)为测定某固体的纯度,现用的酸性KMnO4溶液进行滴定。(已知:)
①确称取固体溶于水配成溶液,下列仪器中肯定需要的是_______(填仪器名称)。
②取溶液置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液。滴定终点的现象为_______,固体的纯度为_______。
【答案】
(1)锰酸钾
(2) 平衡气压,便于浓盐酸顺利滴下
(3)溶液
(4)在装置A、B之间增加装盛有饱和食盐水的洗气瓶
(5)500mL容量瓶、胶头滴管 滴入最后一滴酸性KMnO4溶液,溶液由无色变浅紫红色,且30s不恢复
【解析】本题是利用氯气氧化制备,装置图中最左边的装置是氯气发生装置,中间是制备高锰酸钾的装置,在制备的时候要注意溶液的酸碱性,从而提高产率,最后要注意尾气处理问题。
(1)K2MnO4中锰的化合价是+6价,其名称是锰酸钾;
(2)装置A中是二氧化锰和浓盐酸反应制氯气,其方程式是:;a可以平衡气压,其作用是:平衡气压,便于浓盐酸顺利滴下;
(3)C的作用是吸收反应不完的 Cl2,可用 NaOH溶液吸收, 故C中盛装的试剂是:溶液;
(4)锰酸钾在浓强碱溶液中可稳定存在,碱性减弱时易发生,一部分转化为,导致最终KMnO4的产率低,而浓盐酸易挥发,直接导致B中NaOH溶液的浓度减小,故改进措施是:在装置A、B之间增加装盛有饱和食盐水的洗气瓶;
(5)①配制一定物质的量浓度的溶液,需必须的仪器图中有的是容量瓶、胶头滴管;②(3)KMnO4溶液呈紫色,与反应,紫色褪去,消耗完时,溶液变成浅紫红色,故滴定终点的现象为:滴滴入最后一滴酸性KMnO4溶液,溶液由无色变浅紫色,且30s不恢复;,则,即25.00mL溶液中NaHSO3的物质的量为,500mL溶液中NaHSO3的物质的量为,NaHSO3固体的质量为,纯度为。
18.硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式___________。为提高浸出速率,除适当增加温度外,还可采取的措施有___________(写出两条)。
(2)利用___________的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是___________(写化学式)。
(3)“净化除杂”需先加H2O2溶液,然后再调节溶液的pH约为5,调节pH = 5的目的是___________。
(4)“粗硼酸”中的主要杂质是___________(填名称)。
(5)硼氢化钠(NaBH4)与氢化铝锂(LiAlH4)具有相似的结构,是有机合成中的重要还原剂,试写出氢化铝锂(LiAlH4)的电子式___________。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___________。
【答案】
(1)Mg2B2O5·H2O + 2H2SO4=MgSO4 + H3BO3 适当增加硫酸浓度 、搅拌等
(2)Fe3O4 SiO2与CaSO4
(3)使Al3+和Fe3+生成沉淀而除去
(4)MgSO4
(5)
(6)2H3BO3+3Mg 3MgO+2B+3H2O
【解析】以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3),由流程可知,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,“净化除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,调节溶液的pH约为5,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3。
(1)Mg2B2O5•H2O与硫酸反应的化学方程式Mg2B2O5•H2O+2H2SO42H3BO3+2MgSO4,为提高浸出速率,除适当增加温度外,还可采取的措施适当提高硫酸浓度或浸出时搅拌;
(2)利用Fe3O4的磁性,可将其从“浸渣”中分离.“浸渣”中还剩余的物质是SiO2、CaSO4,故答案为Fe3O4;SiO2、CaSO4;
(3)“净化除杂”需先加H2O2溶液,作用是将亚铁离子氧化为铁离子.然后在调节溶液的pH约为5,目的是使铁离子、铝离子形成氢氧化物沉淀而除去;
(4)最后浓缩结晶时硫酸镁易结合水以晶体析出,则“粗硼酸”中的主要杂质是硫酸镁,故答案为硫酸镁;
(5)LiAlH4为离子化合物,含离子键、共价键,其电子式为;
(6)以硼酸和金属镁为原料可制备单质硼的化学方程式为2H3BO3B2O3+3H2O、B2O3+3Mg2B+3MgO,总反应为2H3BO3+3Mg 3MgO+2B+3H2O。
19.目前,“低碳经济”备受关注,的转化和利用是一个热门的研究课题。回答下列问题:
(1)用甲醇、和合成一种新材料(碳酸二甲酯,,简称),原理为:
①
②
则 _______。
(2)在恒容密闭容器中按投料直接合成,一定条件下,平衡时的转化率如图所示,则:
①_______(填“>”、“
相关试卷
这是一份江苏省淮安市高中校协作体2023届高三上学期期中化学试题Word版含答案,文件包含江苏省淮安市高中校协作体2023届高三上学期期中化学试题docx、高三期中化学试卷参考答案docx等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
这是一份江苏省泰州中学2022-2023学年高三上学期期初调研考试化学试题(Word版含答案),共10页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。
这是一份2022淮安车桥中学高二上学期入学调研(A)化学试题含答案,共17页。试卷主要包含了选择题的作答,非选择题的作答,下列说法正确的是,下列关于化合物的说法正确的是等内容,欢迎下载使用。









