
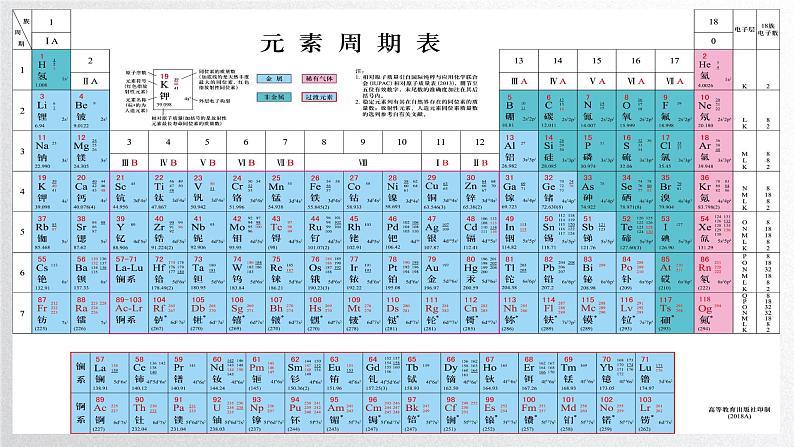



高中化学人教版 (2019)必修 第一册第二节 元素周期律图片课件ppt
展开
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律图片课件ppt,共25页。PPT课件主要包含了思考与交流,原子半径逐渐增大,原子半径逐渐减小,电子层数和核电荷数,+1→0,+1→+5,-4→-1→0,+1→+7,+1到+7,-4到-1等内容,欢迎下载使用。
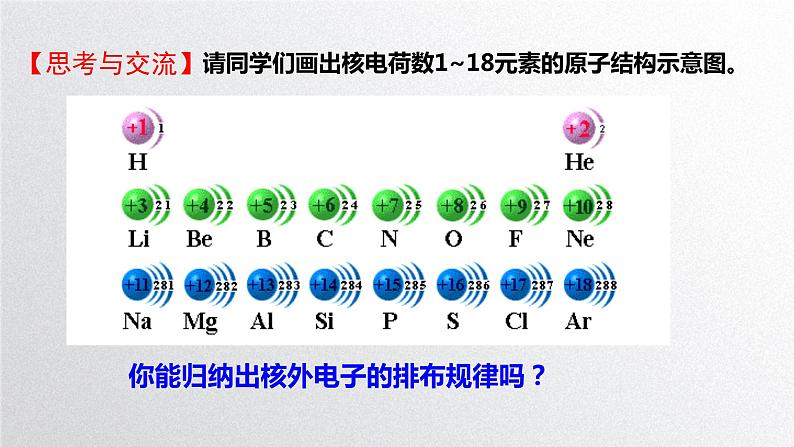
请同学们画出核电荷数1~18元素的原子结构示意图。
你能归纳出核外电子的排布规律吗?
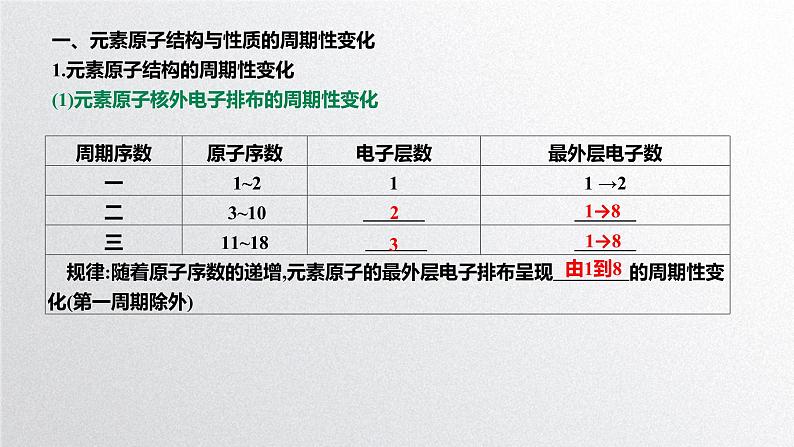
一、元素原子结构与性质的周期性变化1.元素原子结构的周期性变化(1)元素原子核外电子排布的周期性变化
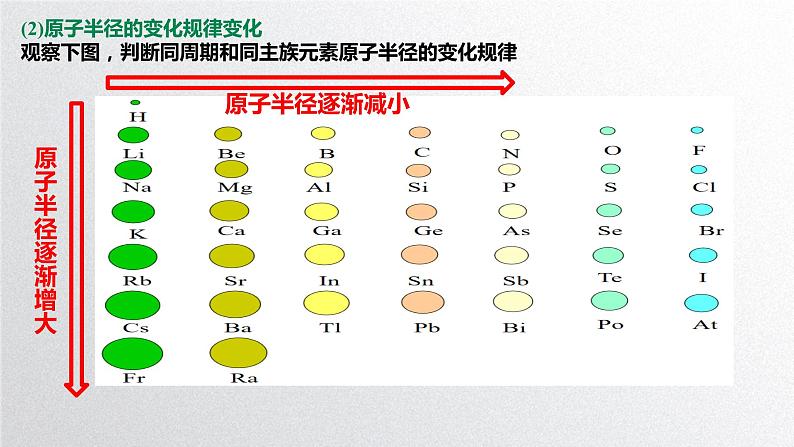
(2)原子半径的变化规律变化观察下图,判断同周期和同主族元素原子半径的变化规律
同周期主族元素: 从左到右原子半径依次减小(除稀有气体)
B. 同主族元素: 从上到下原子半径逐渐变大
【思考与讨论】主族元素原子半径的规律
C.短周期主族元素中,原子半径最大的是
D.影响原子半径的因素:
H是所有原子中半径最小的原子
2.元素性质的周期性变化(1)元素主要化合价的周期性变化
【典例1】 下列各组粒子,按半径由大到小顺序排列正确的是 ( )A. Mg、Ca、K、Na B. S2-、Cl-、K+、Na+ C. Br-、Br、Cl、S D. Na+、Al3+、Cl-、F-
[解析] K、Ca比Na、Mg多1个电子层,故有r(K)>r(Ca)>r(Na)>r(Mg),A项错误;S2-、Cl-、K+三离子核外电子排布相同,核电荷数越小,离子半径越大,又因K+比Na+多1个电子层,故有r(S2-)>r(Cl-)>r(K+)>r(Na+),B项正确;Br-比Br多1个电子,半径大,Br比Cl多1个电子层,故r(Br-)>r(Br)>r(Cl),但r(Cl)r(F-)>r(Na+)>r(Al3+),D项错误。
【变式1】.下列各组微粒半径大小比较中,正确的是( )A.CBr C.Na+F-
[解析] 根据同周期主族元素从左到右,原子半径逐渐减小,则半径C>N>O,A错误;根据同主族元素从上到下,原子半径逐渐增大,则半径Br>Cl>F,B错误;根据具有相同电子层结构的离子,核电荷数越大,离子半径越小,则Na+>Mg2+>Al3+,C错误。
【方法技巧】 “三看”法比较简单粒子的半径大小“一看”电子层数:一般情况下,当电子层数不同时,电子层数越多,半径越大。例:r(Li)r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。例:r(Cl-)>r(Cl);r(Fe2+)>r(Fe3+)。
二、实验探究:第三周期元素性质的递变
思考交流:根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律?
Na Mg Al Si P S Cl
电子层数相同,核电荷数增大,半径减小
失电子能力减弱,得电子能力增强
金属性减弱,非金属性增强
◕活动一、探究Na、Mg、Al 金属性强弱
冷水不反应,加热少量气泡,溶液不变红
Na > Mg > Al
◕活动一、探究Na、Mg、Al金属性强弱
2Na+2H2O=2NaOH+H2↑
Mg+2H2O(沸水)=Mg(OH)2+H2↑
分组实验:向氯化铝溶液中加入氨水,将生成的沉淀分装在两个试管中,分别加入盐酸和氢氧化钠溶液,观察现象。
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+
Al(OH)3+ 3H+ = Al3+ + 3H2O
Al(OH)3+ OH- = AlO2- + 2H2O
两性氢氧化物:与酸、碱都反应,生成盐和水的氢氧化物
◕活动二、探究Na、Mg、Al金属性强弱 ——NaOH、Mg(OH)2、Al(OH)3碱性强弱
最高价氧化物对应的水化物碱性越强,元素金属性
◕活动二、探究Na、Mg、Al金属性强弱——NaOH、Mg(OH)2、Al(OH)3碱性强弱
实验探究:第三周期元素性质的递变
如何证明Si、P、S、Cl的非金属性逐渐增强呢?
单质与氢气反应生成气态氢化物的难易最高价氧化物的水化物的酸性强弱气态氢化物的稳定性
②Si、P、S、Cl的非金属性的递变规律
HClO4 > H2SO4 > H3PO4 > H2SiO3
Cl > S > P > Si
【典例2】下列叙述不正确的是( )A. Na、Mg、Al 最高化合价依次升高 B. N、O、F 非金属性依次减弱C. P、S、Cl 最高价氧化物对应水化物的酸性依次增强D. Li、Na、K 原子的电子层数依次增多
[解析] Na、Mg、Al最高正化合价分别为+1、+2、+3价,逐渐升高,A正确;同周期主族元素从左到右,非金属性逐渐增强,则N、O、F的非金属性逐渐增强,B错误;P、S、Cl的非金属性逐渐增强,则最高价氧化物对应水化物的酸性逐渐增强,C正确;Li、Na、K分别处于第一、二、三周期,则电子层数依次增多,D正确。
1、以第三周期元素为例
①原子的失电子能力。失电子能力越强,金属性越强。②与水或酸反应的的难易程度。与水反应越剧烈,金属性越强。③最高价氧化物对应水化物的碱性。最高价氧化物对应水化物的碱性越强,金属性越强。
①原子的得电子能力。得电子能力越强,非金属性越强。②与氢气化合的难易程度。与氢气反应越容易,非金属性越强。③最高价氧化物对应水化物的酸性。最高价氧化物对应水化物的酸性越强,非金属性越强。
1.判断正误(正确的打“√”,错误的打“×”)。(1)从Li→F,Na→Cl,元素的最高化合价呈现从+1→+7价的变化。 ( )(2)同周期元素的原子半径从左到右一定依次减小。 ( )
[解析] 第二周期中的氧元素没有最高正价,氟元素没有正价。
[解析] 同周期的主族元素的原子半径从左到右逐渐减小,稀有气体元素的原子半径与同周期中相邻非金属元素的原子半径因测定依据不同,不具有可比性。
(3)同周期中,第ⅠA族元素(H除外)金属性最强,第ⅦA族元素非金属性最强。 ( ) (4)同一周期元素的原子,半径越小越容易失电子。 ( )(5)第三周期非金属元素含氧酸的酸性从左到右依次增强。 ( )
[解析] 同周期中,随着原子序数的递增,元素金属性逐渐减弱,非金属性逐渐增强。
[解析]同一周期元素的原子,半径越小越容易得电子。
[解析]第三周期非金属元素的最高价含氧酸的酸性从左到右依次增强。
2.下图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示( )A. 电子层数B. 最外层电子数C. 最高化合价D. 原子半径
3.如图为周期表中短周期的一部分。已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )A.a的最高价氧化物对应水化物有两性B.b与d组成的化合物不能与水反应C.c的单质能与强碱反应生成两种盐D.非金属性:c>d>b>a
[解析] a应为P,所以b为S,d为O,c为Cl。 P的最高价氧化物对应水化物是H3PO4,是中强酸,A项错误; SO2、SO3均能与水反应,B项错误; Cl2和NaOH反应可生成NaCl和NaClO两种盐,C项正确;非金属性应为O>Cl>S>P ,D项错误。
4.如图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )A. Z、N两种元素的离子半径相比,前者较大B. N、P两种元素的气态氢化物的 稳定性相比,前者较稳定C. 由X与M两种元素组成的化合物 不能与任何酸反应,但能与强碱反应D. Z的氧化物能分别溶解于Y的氢氧 化物和P的氢化物的水溶液中
相关课件
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律优秀ppt课件,共25页。PPT课件主要包含了本节重点,本节难点,半径增大,金属性增强,思考1,思考2,“一看”电子层数,“二看”核电荷数,主族元素的主要化合价,原子半径逐渐减小等内容,欢迎下载使用。
这是一份高中化学第一节 原子结构与元素周期表教学ppt课件,共20页。PPT课件主要包含了镓的故事,学习目标,核外电子排布的规律等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律课堂教学课件ppt,共37页。










