

2022届高考化学一轮复习 微题型55 控制变量法探究影响反应速率的因素(解析版)
展开这是一份2022届高考化学一轮复习 微题型55 控制变量法探究影响反应速率的因素(解析版),共9页。试卷主要包含了某恒容密闭容器中进行反应,下列说法正确的是等内容,欢迎下载使用。
1.(2019·内蒙古包头四校联考)已知x溶液能与氢氧化钠溶液反应,现有四份20 mL 4 ml·L-1的氢氧化钠溶液分别与下列四种x溶液反应,其中反应最快的是( )
A.10 ℃,20 mL 3 ml·L-1的x溶液
B.20 ℃,30 mL 2 ml·L-1的x溶液
C.20 ℃,10 mL 5 ml·L-1的x溶液
D.10 ℃,10 mL 2 ml·L-1的x溶液
2.(2019·贵阳模拟)在一密闭容器中充入1 ml H2和1 ml I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)2HI(g) ΔH<0,下列说法正确的是( )
A.保持容器容积不变,向其中加入1 ml H2(g),反应速率一定加快
B.保持容器容积不变,向其中加入1 ml N2(N2不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入1 ml N2(N2不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入1 ml H2(g)和1 ml I2(g),反应速率一定加快
3.(2019·福州质检)某恒容密闭容器中进行反应:SO2(g)+NO2(g)SO3(g)+NO(g) ΔH=a kJ·ml-1;某科研小组通过实验测出SO2的转化率(SO2、NO起始量一定)随条件P的变化情况如图所示,下列说法中正确的是( )
A.10~15 min内反应速率小于15~20 min的反应速率,P为升高温度
B.10~20 min内反应速率小于20~40 min的反应速率,P为减小SO3的浓度
C.10~15 min内反应速率大于40~50 min的反应速率,P为减小压强
D.该反应中,随着反应物浓度的减小,反应速率一直减小
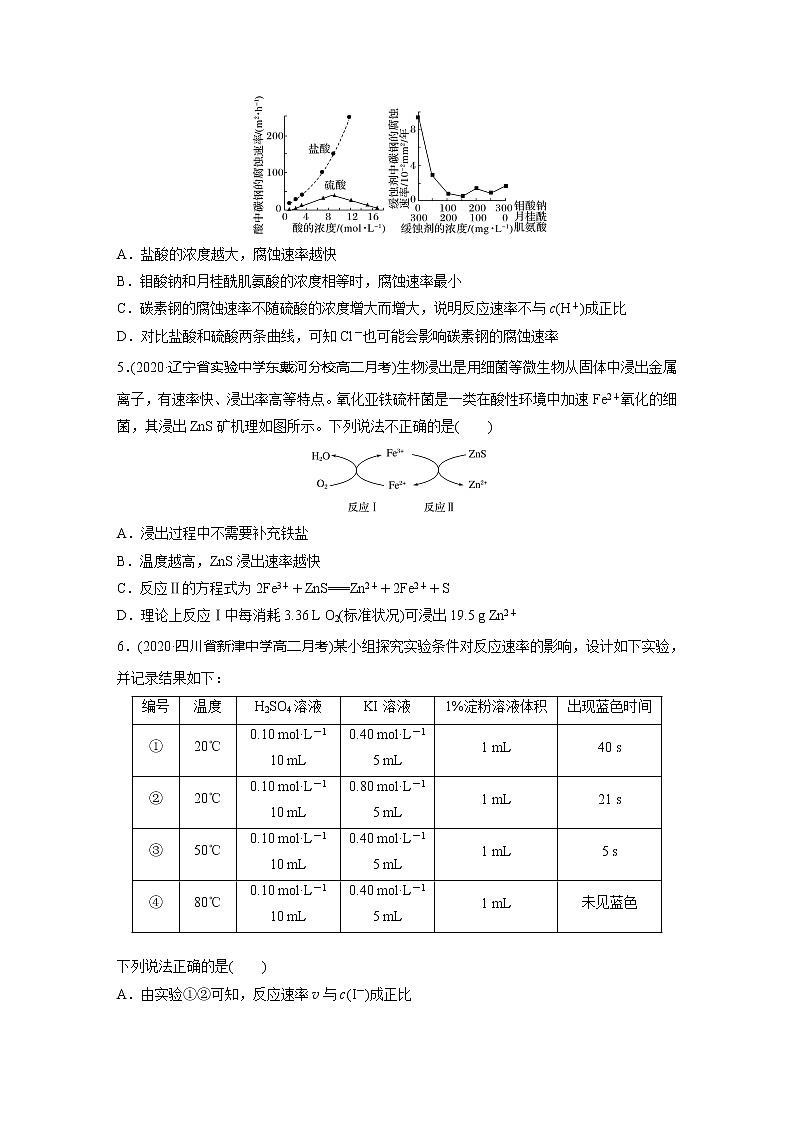
4.(2020·安徽省含山中学月考)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )
A.盐酸的浓度越大,腐蚀速率越快
B.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D.对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率
5.(2020·辽宁省实验中学东戴河分校高二月考)生物浸出是用细菌等微生物从固体中浸出金属离子,有速率快、浸出率高等特点。氧化亚铁硫杆菌是一类在酸性环境中加速Fe2+氧化的细菌,其浸出ZnS矿机理如图所示。下列说法不正确的是( )
A.浸出过程中不需要补充铁盐
B.温度越高,ZnS浸出速率越快
C.反应Ⅱ的方程式为2Fe3++ZnS===Zn2++2Fe2++S
D.理论上反应Ⅰ中每消耗3.36 L O2(标准状况)可浸出19.5 g Zn2+
6.(2020·四川省新津中学高二月考)某小组探究实验条件对反应速率的影响,设计如下实验,并记录结果如下:
下列说法正确的是( )
A.由实验①②可知,反应速率v与c(I-)成正比
B.实验①②③④中,应将H2SO4溶液与淀粉溶液先混合
C.在I-被O2氧化过程中,H+只是降低活化能
D.由实验③④可知,温度越高,反应速率越慢
7.(2021·简阳市阳安中学高二月考)下列说法正确的是( )
A.使用催化剂能够降低化学反应的反应热(ΔH)
B.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
C.探究温度对硫代硫酸钠与硫酸反应速率的影响时,应用以下操作顺序:先将两种溶液混合并计时,再用水浴加热至设定温度,测反应速率
D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加入2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象
8.(2020·北京延庆期中)某同学在实验室研究锌与酸的反应,实验数据如下:
分析上述数据,回答下列问题
(1)实验1和2表明,________对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a=________。
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如右图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。
该同学对产生这一现象的原因,提出两种假设:
a.氯离子对反应起促进作用,加快了反应的进行;
b.____________________________________________________________,减缓了反应的进行。
为进一步证实自己的猜想,该同学在室温下,分别取5 mL 0.2 ml·L-1盐酸,一份加入一定量的固体______(填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是________________________________________________________________________
__________________________________________________(结合化学方程式作出合理解释)。
9.(2020·安徽省含山中学月考)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2Oeq \\al(2-,7)转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
测得实验①和②溶液中的Cr2Oeq \\al(2-,7)浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化的离子方程式为____________________________________
________________________________________________________________________。
(3)实验①和②的结果表明__________________________________________________;
实验①中O~t1时间段反应速率v(Cr3+)=________ ml·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用:
假设二:________________________________________________________________________;
假设三:________________________________________________________________________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2Oeq \\al(2-,7)的浓度可用仪器测定]
10.(2020·怀仁市第一中学高二月考)KI溶液在酸性条件下能与氧气反应。现有以下实验记录,回答下列问题:
(1)该反应的离子方程式为_______________________________________________________。
(2)该实验的目的是探究________对反应速率的影响。
(3)实验试剂除了1 ml·L-1 KI溶液、0.1 ml·L-1 H2SO4溶液外,还需要的指示剂是________。实验仪器除了试管、试剂瓶、胶头滴管、温度计外,还需要的仪器是________。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是________(填字母)。
A.温度 B.指示剂的浓度
C.试剂的用量(体积) D.试剂添加的顺序
(5)若要进行酸性强弱对反应速率的影响的探究实验,你会采取的措施是________________________________________________________________________。
11.碘在科研与生活中有重要作用,某兴趣小组用0.20 ml·L-1 KI、0.4%淀粉溶液、0.20 ml·L-1 K2S2O8、0.010 ml·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2Oeq \\al(2-,8)+2I-===2SOeq \\al(2-,4)+I2(慢)
I2+2S2Oeq \\al(2-,3)===2I-+S4Oeq \\al(2-,6)(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2Oeq \\al(2-,3)与S2Oeq \\al(2-,8)初始的物质的量需满足的关系为n(S2Oeq \\al(2-,8))∶n(S2Oeq \\al(2-,3))________________。
(2)如果实验中不使用Na2S2O3溶液,可能存在的不足是
________________________________________________________________________。
(3)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表所示:
表中V1=______ mL,理由是____________________________________________________;
V2=______ mL,理由是_________________________________________________________。
显色时间t1大约是________________。
(4)根据表中数据可以得出的结论是________________________________________________
______________________________________________________________________________。
答案精析
1.C 2.A 3.A 4.C
5.B [根据总反应:O2+4H++2ZnS===2S+2Zn2++2H2O可知浸出过程中不需要补充铁盐,A正确;温度过高,会导致氧化亚铁硫杆菌的蛋白质发生变性,而降低浸出速率,B错误;由图中转化可知反应Ⅱ的方程式为2Fe3++ZnS===2Fe2++S+Zn2+,C正确;由O2+4H++2ZnS===2S+2Zn2++2H2O可知,理论上反应Ⅰ中每消耗标准状况下3.36 L O2,其物质的量是n(O2)=eq \f(3.36 L,22.4 L·ml-1)=0.15 ml,则可浸出Zn2+的物质的量是n(Zn)=2n(O2)=0.15 ml×2=0.30 ml,则浸出Zn2+的质量m(Zn2+)=0.30 ml×65 g·ml-1=19.5 g,D正确。]
6.A [实验①②中其它条件相同,c(I-):①<②,且反应速率:①<②,所以反应速率v与c(I-)成正比,A正确;实验①~④中,应将KI溶液与淀粉溶液先混合,再加入H2SO4溶液,在酸性条件下发生氧化还原反应生成碘单质,测定溶液变色的时间,B错误;在I-被O2氧化过程中,H+除了作为催化剂降低活化能,还作为反应物参加反应,C错误;由实验④温度越高,生成的碘单质能被氧气继续氧化,所以④不变色,D错误。]
7.D [催化剂能降低反应的活化能从而改变反应速率,但不能改变反应的反应热,故A错误;不同的催化剂的催化效果不一定相同,所以同等条件下二者对H2O2分解速率的改变不一定相同,故B错误;该实验要求开始时温度相同,然后改变温度,探究温度对反应速率的影响,应先分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度后再混合,若是先将两种溶液混合后再用水浴加热,随着热量的散失,测得的反应速率偏低,故C错误;探究催化剂对H2O2分解速率的影响时,只有催化剂不同,其他因素必须完全相同,这两个实验中其它因素完全相同,只有催化剂不同,所以可以探究催化剂对双氧水分解速率的影响,故D正确。]
8.(1)固体表面积(接触面积) (2)0.10 (3)硫酸根离子对反应起抑制作用 Na2SO4[或K2SO4或(NH4)2SO4] (4)Zn+CuSO4===Cu+ZnSO4,铜、锌、稀硫酸构成原电池,加快反应速率
解析 (1)根据控制变量法,实验1和2只有锌状态不同,说明固体表面积对反应速率有影响。(2)实验1和3研究的是反应物浓度对反应速率的影响,根据控制变量法,只能让硫酸的浓度不同,锌质量和锌状态应相同,所以a=0.10 g。(3)两组实验,锌的状态、质量相同,氢离子浓度相同,只有酸根离子不同,所以反应速率不同的原因可能是:a氯离子对反应起促进作用,加快了反应的进行;b硫酸根离子对反应起抑制作用,减缓了反应的进行。取两份5 mL 0.2 ml·L-1盐酸,一份加入一定量的固体硫酸钠,另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小,若加入硫酸钠的盐酸和锌反应速率慢,则说明硫酸根离子对反应起抑制作用。(4)锌粒和稀硫酸反应制取氢气时,加入少量CuSO4粉末,发生反应:Zn+CuSO4===Cu+ZnSO4,生成的铜、锌、稀硫酸构成原电池,反应速率加快。
9.(1)20 20 (2)Cr2Oeq \\al(2-,7)+3H2C2O4+8H+===6CO2↑+2Cr3++7H2O (3)溶液pH对该反应的速率有影响 eq \f(2c0-c1,t1)
(4)Al3+起催化作用 SOeq \\al(2-,4)起催化作用
(5)
解析 (1)为控制变量,保证Cr2Oeq \\al(2-,7)、催化剂的浓度不变,控制溶液总体积为100 mL即可。(2)草酸被氧化为二氧化碳的离子方程式为Cr2Oeq \\al(2-,7)+3H2C2O4+8H+===6CO2↑+2Cr3++7H2O。(3)实验①和②的结果表明溶液pH对该反应的速率有影响,pH越小速率越快;实验①中O~t1时间段反应速率v(Cr3+)=eq \f(2c0-c1,t1) ml·L-1·min-1。(4)起催化作用的成分可能是Al3+起催化作用、SOeq \\al(2-,4)起催化作用。
10.(1)4H++4I-+O2===2I2+2H2O (2)温度 (3)淀粉溶液 秒表 (4)BCD (5)保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
解析 (1)在酸性溶液中氧气把碘离子氧化为单质碘,该反应的离子方程式为4H++4I-+O2===2I2+2H2O。(2)根据表中数据分析,该实验目的是探究温度对反应速率的影响。(3)为测定显色时间,产物中有碘单质生成,还需要的试剂是淀粉溶液,实验现象为无色溶液变蓝色;由于需要测定显色时间,实验仪器除了试管、试剂瓶、胶头滴管、温度计外,还需要的仪器是秒表。(4)设计实验必须保证其他条件不变,只改变一个条件,才能得到准确的结论,还必须控制不变的是指示剂的浓度、试剂的用量(体积)和试剂添加的顺序,故答案为BCD。(5)若要进行酸性强弱对反应速率的影响的探究实验,采取的措施应该是保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验。
11.(1)>1∶2 (2)显色时间太短,不易测量 (3)7.5 保证每次实验溶液总体积相等 1 保证淀粉溶液的用量相同 72 s(或54 s~72 s) (4)反应速率与反应物浓度成正比关系(或反应物浓度越大,反应速率越快)
解析 (1)由已知可得,向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,先发生反应S2Oeq \\al(2-,8)+2I-===2SOeq \\al(2-,4)+I2(慢),后发生反应I2+2S2Oeq \\al(2-,3)===2I-+S4Oeq \\al(2-,6)(快),当溶液中的Na2S2O3耗尽后,碘才能与淀粉作用使溶液颜色由无色变为蓝色。实验①与实验②对照,溶液总体积是25 mL,为确保溶液总体积不变,所以V1=7.5 mL,理由是保证每次实验溶液总体积相等。V2=1 mL,理由是保证淀粉溶液的用量相同。对比几组实验数据,得关系式为eq \f(10,7.5)=eq \f(t1,54),时间t1大约是72 s。
编号
温度
H2SO4溶液
KI溶液
1%淀粉溶液体积
出现蓝色时间
①
20℃
0.10 ml·L-1
10 mL
0.40 ml·L-1
5 mL
1 mL
40 s
②
20℃
0.10 ml·L-1
10 mL
0.80 ml·L-1
5 mL
1 mL
21 s
③
50℃
0.10 ml·L-1
10 mL
0.40 ml·L-1
5 mL
1 mL
5 s
④
80℃
0.10 ml·L-1
10 mL
0.40 ml·L-1
5 mL
1 mL
未见蓝色
实验序号
锌质量
锌状态
c(H2SO4)
V(H2SO4)
金属消失时间
1
0.10 g
颗粒
0.5 ml·L-1
50 mL
500 s
2
0.10 g
粉末
0.5 ml·L-1
50 mL
50 s
3
a g
颗粒
1.0 ml·L-1
50 mL
125 s
实验编号
初始pH
废水样品体积/mL
草酸溶液体积/mL
蒸馏水体积/mL
①
4
60
10
30
②
5
60
10
30
③
5
60
_______
_______
实验方案
(不要求写具体操作过程)
预期实验结果和结论
实验编号
①
②
③
④
⑤
温度/℃
30
40
50
60
70
显色时间/s
160
80
40
20
10
实验序号
试剂体积V/mL
显色时间t/s
K2S2O8溶液
KI
水
Na2S2O3溶液
淀粉溶液
①
10
10
0
4
1
26.8
②
5
10
5
4
1
54.0
③
2.5
10
V1
4
1
108.2
④
10
5
5
4
1
53.8
⑤
5
7.5
7.5
4
V2
t1
用等物质的量的K2SO4·Al2(SO4)3·24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验
反应进行相同时间后,若溶液中Cr2Oeq \\al(2-,7)浓度大于实验①中Cr2Oeq \\al(2-,7)浓度则假设一成立,若Cr2Oeq \\al(2-,7)浓度相同,则假设一不成立
相关试卷
这是一份高考化学一轮复习讲练 第7章 专题突破24 控制变量探究影响化学反应速率的因素 (含解析),共5页。试卷主要包含了常见考查形式,解题策略,实例分析等内容,欢迎下载使用。
这是一份2022年高考化学一轮复习讲义第7章第33讲 微专题17 控制变量探究影响化学反应速率的因素 (含解析),共4页。试卷主要包含了常见考查形式,解题策略,实例分析等内容,欢迎下载使用。
这是一份(新高考)高考化学一轮复习讲义第7章热点强化13控制变量探究影响化学反应速率的因素(含解析),共5页。试卷主要包含了常见考查形式,解题策略,实例分析等内容,欢迎下载使用。












