





所属成套资源:~2022学年人教版 (2019)高一化学必修第一册精品课件 (全套)
人教版 (2019)必修 第一册第一节 原子结构与元素周期表图片课件ppt
展开
这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表图片课件ppt,共40页。PPT课件主要包含了自主预习·新知导学,合作探究·释疑解惑,课堂小结,完成表格,答案A,答案C等内容,欢迎下载使用。
自主预习·新知导学
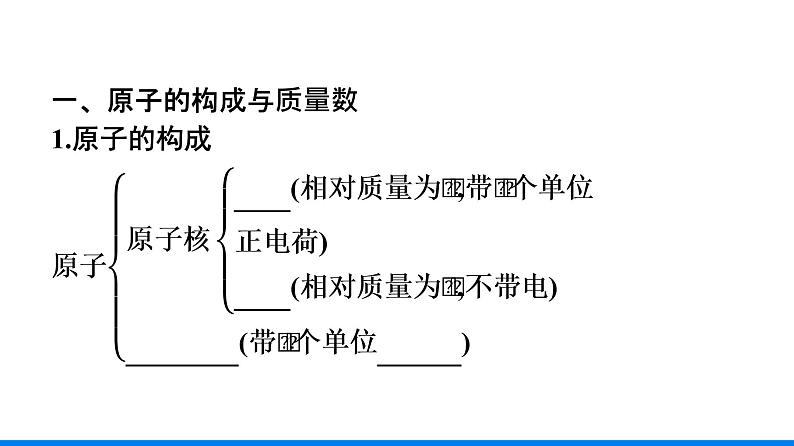
一、原子的构成与质量数1.原子的构成
2.质量数(1)质量数。质子和中子的相对质量都近似为1,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值即为质量数,用符号A表示。(2)质量关系:质量数(A)= 质子数(Z) + 中子数(N) 。
二、原子核外电子的排布1.电子层(1)定义:在含有多个电子的原子里,电子分别在能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层。
(2)不同电子层的表示及能量关系。
2.电子的能量(1)在多电子原子中,电子的能量是不相同的。(2)电子能量与运动的区域。
3.电子排布的规律(1)电子一般总是先从内层排起,当一层充满后再填充下一层。(2)原子核外第n层最多能容纳的电子数为2n2。(3)无论原子有几个电子层,其最外层中的电子数最多只有8个(K层只有2个)。(4)原子最外电子层有8个电子(最外层为K层时,最多只有2个电子)的结构是相对稳定的结构。
【效果自测】 1.判断正误,正确的画“√”,错误的画“×”。(1)所有原子都由质子、中子和核外电子构成。( )(2)某种氯原子的中子数是18,则其质量数是35,核外电子数是17。( )
(4)某原子M层电子数为L层电子数的4倍。( )(5)某离子M层和L层电子数均为K层的4倍。( )(6)离子的核电荷数一定等于其核外电子数。( )
3.根据下列叙述,写出元素名称并画出原子结构示意图。
合作探究·释疑解惑
问题引领1.原子的质量主要由哪些粒子决定?提示:质子和中子。2.如何确定原子的质子数?提示:质子数=核电荷数=核外电子数=质量数-中子数。
探究任务1 原子的构成及各粒子数目之间的关系
归纳提升1.构成原子的粒子
2.有关粒子间的关系(1)质量关系。质量数(A)=质子数(Z)+中子数(N)。(2)电性关系。①电中性粒子(原子或分子):核电荷数=核内质子数=核外电子数。②带电离子。质子数≠电子数,具体如下表:
(1)质量数=质子数+中子数,该关系适用于原子和离子。(2)核电荷数(质子数)=核外电子数,只适用于原子和分子。(3)对离子进行电子数与质子数换算时应该注意阳离子和阴离子的区别。
典型例题【例题1】 已知R2+核外有a个电子,核内有b个中子。下列能正确表示R的原子符号的是( )
答案:C解析:R2+核外有a个电子,因此R原子核外有a+2个电子,R原子的核外电子数、质子数、核电荷数均为a+2,其质量数为中子数与质子数之和,即a+b+2。
质量数(A)、质子数(Z)、中子数(N)三个数值,若已知其中任意两个数值,均可利用A=Z+N计算第三个数值。
【变式训练1】 1.核内中子数为N的R2+,质量数为A,则它的n g氧化物中所含质子的物质的量是( )
2.据报道,某些建筑材料会产生具有放射性的 ,从而对人体产生危害。该原子的中子数和核外电子数之差为( )A.136B.50C.86D.222答案:B解析:由 可知,该原子的质量数=222,质子数=核外电子数=86,因此中子数=222-86=136,中子数-核外电子数=136-86=50,B项正确。
探究任务2 原子核外电子排布
问题引领1.当N层上有电子时,M层上的电子是否已排满?提示:不一定。因M层排满时是18个电子,但当M层为最外层时不能超过8个电子,故M层电子数多于8个电子时,就会先排布在N层上。例如:钙原子 。
2.M电子层最多容纳18个电子,为什么钾原子的核外电子排
提示:若钾原子的M层排布9个电子,此时M层就成为最外层,这和电子排布规律中的“最外层的电子最多只能有8个”相矛盾,不符合电子排布的规律,即M层不是最外层时最多排18个电子,而它作为最外层时最多只能排8个电子。
归纳提升1.原子核外电子排布规律的“三最”
2.原子核外电子排布的表示方法(1)原子结构示意图。
①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。②弧线表示电子层。③弧线上数字表示该层上的电子数。
(2)离子结构示意图。①部分金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期的稀有气体元素原子相同的电子层结构。
②非金属元素的原子得电子形成简单离子时,形成和同周期的稀有气体元素原子相同的电子层结构。
典型例题【例题2】 下列各原子结构示意图中电子排布正确的是( )
解析:A项,应该先排满K层再排L层;B项与各层最多排2n2个电子不符,K层最多排2个电子;D项不符合最外层最多能排8个电子的规律。
若核外电子数大于核内质子数(核电荷数),则该粒子为阴离子;若核外电子数小于核内质子数(核电荷数),则该粒子为阳离子;若核外电子数等于核内质子数(核电荷数),则该粒子为原子。
【变式训练2】 1.核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素有( )A.1种B.2种C.3种D.4种答案:B解析:在1~18号元素中,符合题给要求的元素原子的电子排布依次为2、1和2、8、5。










