




高中化学人教版 (新课标)必修1第三章 金属及其化合物第二节 几种重要的金属化合物课前预习课件ppt
展开联想并列举常见的钠的化合物,并用分类的思想对上述物质进行分类。
滴水生火:用脱脂棉包裹少量过氧化钠粉末,用滴管滴加少量水。
吹气生火:用脱脂棉包裹过氧化钠粉末,通过玻璃导管往脱脂棉中吹气。
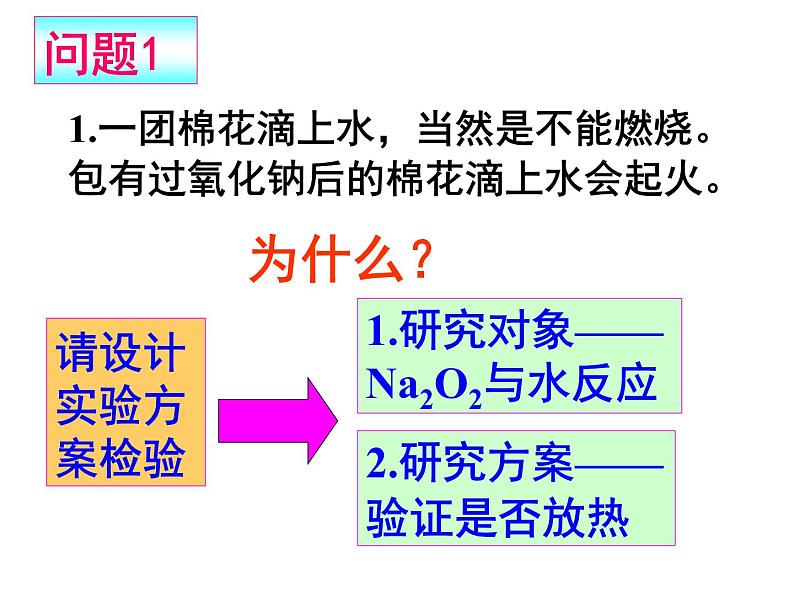
1.一团棉花滴上水,当然是不能燃烧。包有过氧化钠后的棉花滴上水会起火。
1.研究对象——Na2O2与水反应
2.研究方案——验证是否放热
实验3-5:向小试管中加入约一药匙过氧化钠,向其中加入约一滴管水,用带火星的木条检验生成的气体。 用手轻轻摸一摸试管外壁,有什么感觉?向反应后的溶液中加入酚酞溶液,有什么现象发生?
带火星的木条复燃;试管外壁热;滴加酚酞,溶液呈红色
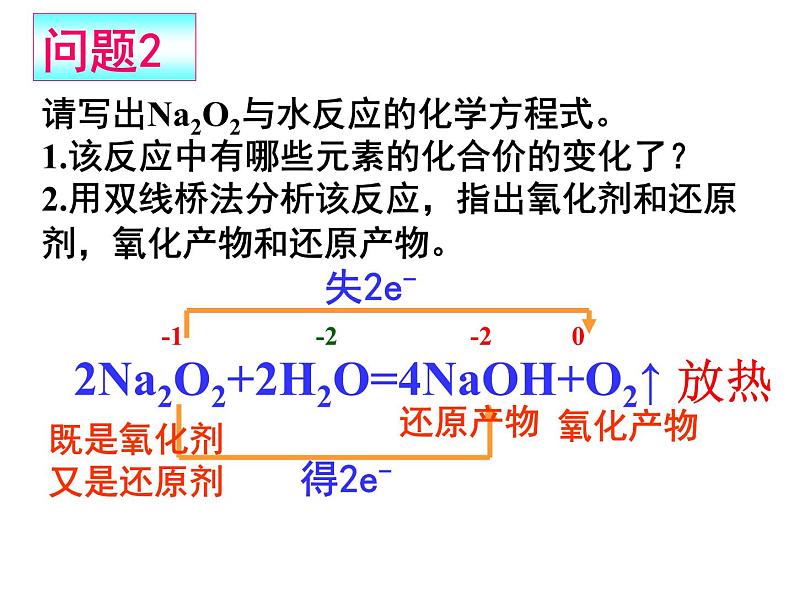
-1 -2 -2 0
2Na2O2+2H2O=4NaOH+O2↑
请写出Na2O2与水反应的化学方程式。1.该反应中有哪些元素的化合价的变化了?2.用双线桥法分析该反应,指出氧化剂和还原剂,氧化产物和还原产物。
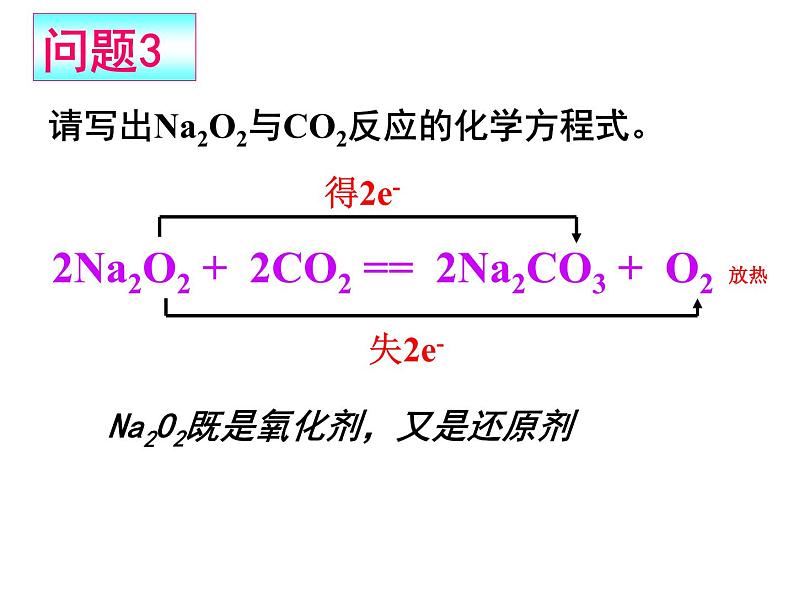
2Na2O2 + 2CO2 == 2Na2CO3 + O2 放热
Na2O2既是氧化剂,又是还原剂
请写出Na2O2与CO2反应的化学方程式。
2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O =2NaOH
2Na2O2+2CO2=2Na2CO3+O2
Na2O+CO2 =Na2CO3
过氧化钠与氧化钠的比较
2Na2O2+4HCl=4NaCl+2H2O+O2↑
Na2O+2HCl=2NaCl+H2O
与酸反应生成盐和水的化合物。如Na2O、CaO、CuO、Fe2O3等。
碱性氧化物的通性:1.与水反应生成碱;2.与CO2等反应生成盐;3.与酸反应生成盐和水。
思考:Na2O2是碱性氧化物吗?
碳酸钠和碳酸氢钠属于哪类物质?观察二者的物理性质?预测它们的性质有哪些异同?
白色粉未,加水结块成晶体,放热
白色粉未,加水部分溶解,感受不到热量变化
1.溶解过程放热2.易溶于水3.溶液显碱性
1.溶解过程微弱放热2.易溶于水,但溶解度比Na2CO3小3.溶液显碱性,但碱性比Na2CO3弱
Na2CO3和NaHCO3分解实验
现象: Na2CO3受热无明显现象;NaHCO3受热产生使澄清石灰水变浑浊的气体——CO2
请写出NaHCO3受热分解的化学方程式。
有其它方法进行实验吗?
以上实验中左右两支盛有澄清石灰水的试管有何现象?
1.向两支盛有Na2CO3和NaHCO3溶液中分别加入盐酸溶液,有何现象?写出反应的化学方程式和离子方程式。
2.Na2CO3和NaHCO3能否与NaOH溶液反应?如果能,写出化学方程式和离子方程式。
3.Na2CO3和NaHCO3能否与CaCl2溶液反应?如果能,写出化学方程式和离子方程式。
①加热固体,看能否产生使澄清的石灰水变浑浊的气体
②加入同浓度盐酸,比较反应速率
③相同温度下,比较溶解性,或溶液碱性强弱
④加入氯化钙溶液,是否产生白色沉淀
1.厨房里,我们不小心将盛有纯碱,小苏打的瓶子弄混了,该怎样区别它们呢?
2.如何实现NaHCO3和 Na2CO3之间相互转化?
Na2CO3 NaHCO3
①固体(加热) ②溶液(NaOH)
1.原理:某些金属或其化合物(离子)灼烧时使火焰呈现出特殊的颜色。
2.操作: 把铂丝(或用铁丝)用稀盐酸洗涤后灼烧,反复多次,至火焰变为无色。 用干净的铂丝蘸某待测溶液或固体,放到酒精灯火焰上灼烧,观察其火焰的颜色。 测完后将铂丝用稀盐酸洗净,在火焰上灼烧至无色。
(1)焰色反应不是燃烧。(2)焰色反应不是化学变化,而是该元素的物理性质。
(1)离子检验,物质鉴别。(2)焰火材料。
钠--黄色钾--紫色(透过蓝色的钴玻璃)
1、与水反应: 2Na2O2+2H2O=4NaOH+O2↑
2、与CO2反应:2Na2O2+2CO2=2Na2CO3 +O2
(有强氧化性、漂白性)
二、碳酸钠和碳酸氢钠
1、与酸反应:CO32- + 2H+ = H2O+CO2↑ HCO3- + H+ = H2O+CO2 ↑
2、受热分解:2NaHCO3==Na2CO3+H2O+CO2 ↑
三、焰色反应:钠—黄 钾—紫
用耐高温的Al2O3制成的坩埚
用耐磨的Al2O3做成的轴承
阅读教材P58,思考下列问题:1.Al2O3有哪些物理性质?2. Al2O3能与哪些物质发生反应?请写出化学方程式和离子方程式。
3.Al2O3属于哪类氧化物?
4.什么是两性氧化物?
阅读教材P58,思考下列问题:1.能用氧化铝和水为原料制取氢氧化铝?2.应该用什么药品制取氢氧化铝呢?
3.用铝盐和碱液反应制取氢氧化铝时,用强碱好还是弱碱好?
可供选用试剂:硫酸铝溶液、NaOH溶液、氨水
制备氢氧化铝宜用铝盐和氨水反应
请写出实验室制取氢氧化铝的化学方程式和离子方程式。
将制得的氢氧化铝放入两支试管中,分别加入稀盐酸和氢氧化钠溶液,振荡,观察现象,分析作出解释,填写下表:
Al(OH)3既能与酸反应又能与碱反应生成盐和水
请写出氢氧化铝与稀盐酸和氢氧化钠溶液反应的化学方程式和离子方程式。
2.氢氧化铝还有什么性质?请用化学方程式表示。
3.氢氧化铝有哪些物理性质?有哪些用途?
1.什么是两性氢氧化物?
①可以中和胃酸。(药物胃舒平的主要成分) ②Al(OH)3作净水剂。 例:明矾净水
既可以与酸反应又可以与碱反应生成盐和水的氢氧化物称为两性氢氧化物。
硫酸铝钾:KAl(SO4)2
硫酸铝钾的电离: KAl(SO4)2 = K++ Al3+ + 2SO42- 溶液中有三种自由移动的离子,两种阳离子,一种阴离子
明矾溶于水后生成Al(OH)3胶体
明矾:KAl(SO4)2·12H2O
Al(OH)3胶体可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清。
1、氧化铝(Al2O3)Al2O3+6H+ = 2Al3+ +3H2OAl2O3+2OH- = 2AlO2- +H2O
2、氢氧化铝 Al(OH)3
Al3++3NH3·H2O==Al(OH)3↓+3NH4+
Al(OH)3+3H+ =Al3+ +3H2O
Al(OH)3+OH-=AlO2- +2H2O
你知道故宫的外墙是用什么颜料粉刷?
FeO是一种黑色粉末,不稳定,在空气里会迅速被氧化为Fe3O4。
主要成分:Fe3O4(俗称磁性氧化铁)
FeO + 2H+ = Fe2+ + H2O
Fe2O3 + 6H+ = Fe3+ + 3H2O
Fe3O4 + 8H+= Fe2+ + 2Fe3++4 H2O
铁有哪些氢氧化物?如何制备铁的氢氧化物?
方案一:能否通过铁和水反应制得?
方案二:能否通过铁的氧化物和水反应得到?
方案三:用可溶性铁盐、亚铁盐与碱溶液反应?
白色絮状沉淀 → 灰绿色 → 红褐色沉淀
FeCl3 + 3NaOH = Fe(OH)3+3NaCl
FeSO4 + 2NaOH =Fe(OH)2 + Na2SO4
实验3-9:在FeCl3、FeSO4分别加入NaOH溶液,观察并记录现象
铁的两种氢氧化物可以分别由相对应的可溶性盐和碱溶液反应制得。
1.为什么在实际操作中几乎看不到白色Fe(OH)2沉淀而只看到灰绿色?
2.能不能通过实验改进,使生成的Fe(OH) 2沉淀能较长时间保持白色?
Fe(OH)2易被氧化的原因:
1.反应的溶液与空气接触;
2.反应试剂溶有氧气;
实验改进的目的:隔绝氧气与反应物和生成物接触
措施:1.用煮沸过的蒸馏水配制FeSO4溶液和NaOH溶液;2.在试管中FeSO4溶液液面上加几滴植物油;3. 胶头滴管的末端伸入FeSO4溶液液面之下;
4Fe(OH)2 + O2+2H2O = 4Fe(OH)3
Fe(OH)2和Fe(OH)3具有哪些性质?请写出化学方程式和离子方程式?
Fe2++2OH-=Fe(OH)2↓
Fe3++3OH-=Fe(OH)3↓
易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
1.将Fe(OH)2露置在空气中加热所得产物为( ) A. FeO B. Fe2O3 C. Fe3O4 D. Fe(OH)32.稀硫酸中加入适量铁粉,反应完全后再加入适量的NaOH溶液,放置片刻,整个过程中观察到的颜色变化是( )A.无色、灰绿色、红褐色 B.无色、浅绿色、白色、灰绿色、红褐色C.灰绿色、红褐色、蓝色 D.灰绿色、白色、浅绿色、灰绿色、红褐色
苹果汁是人们喜爱的饮料,但是现榨的苹果汁在空气中会慢慢的由浅绿色变为棕黄色,为什么呢?
O2 Fe2+ Fe3+
Fe2+(浅绿色)→Fe3+(棕黄色),如何判断FeCl2溶液是否有部分Fe2+被氧化成Fe3+?
实验3-10:向FeCl3和FeCl2溶液中分别加入KSCN溶液
Fe3++3SCN-=Fe(SCN)3 (血红色溶液)
(可用来检验Fe3+的存在)
如何防止FeCl2溶液的Fe2+被氧化成Fe3+?
Fe3+具有氧化性2Fe3++Fe=3Fe2+
Fe2+具有还原性2Fe2++Cl2=2Fe3++2Cl-
思考:怎样检验溶液中有Fe2+离子?
Fe2+ Fe3+
还原剂:金属单质,如铁、铜、S2-、I-等 氧化剂:Cl2、O2 、 H2O2、 Na2O2 、 KMnO4等
Fe2+和Fe3+的相互转化
Fe3+和Fe2+的鉴别
白色沉淀→灰绿色→红褐色
不变红色,若再通Cl2则变血红色
3. 要证明某溶液中不含Fe3+,而可能含有Fe2+,进行如下实验操作时最佳顺序为( )①滴入足量氯水 ②加入铁粉 ③滴入KSCN溶液 ④滴入NaOH溶液 A. ①③ B. ③② C. ③① D. ③④4.要除去FeCl2溶液中少量的FeCl3,可行的办法是 ( ) A.滴入KSCN溶液 B.通入氯气 C.加入铜粉 D.加入铁粉
误食重金属盐中毒的原因:重金属离子使蛋白质变性,从而使蛋白质失去了生理活性。
有明显沉降,溶液半透明
沉淀沉在底部 溶液接近透明
沉淀沉在底部 溶液接近透明
浑浊 , 略有沉降
明矾和硫酸铁溶液可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,可用做净水剂。
1、铁的氧化物(FeO 、 Fe2O3、 Fe3O4)
2、铁的氢氧化物( Fe(OH)2 Fe(OH)3 )
(2)Fe3+与Fe2+的相互转化
(3) Fe3+与Fe2+鉴别方法
2Fe2++Cl2 = 2Fe3++2Cl-
2Fe3++Fe = 3Fe2+
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
人教版 (新课标)必修1第二节 几种重要的金属化合物备课课件ppt: 这是一份人教版 (新课标)必修1第二节 几种重要的金属化合物备课课件ppt,共51页。PPT课件主要包含了金属化合物,金属氧化物,金属氢氧化物,酸性氧化物的通性,CO2+2NaOH,碱性氧化物的通性,Na2O,Na2O2,实验探究,不稳定等内容,欢迎下载使用。
人教版 (新课标)必修1第二节 几种重要的金属化合物备课课件ppt: 这是一份人教版 (新课标)必修1第二节 几种重要的金属化合物备课课件ppt,共22页。PPT课件主要包含了铝的重要化合物,物理性质,化学性质,和酸反应,和强碱反应,氧化物的分类,实验室制法,中和胃酸,HCl,NaOH等内容,欢迎下载使用。
人教版 (新课标)必修1第三章 金属及其化合物第二节 几种重要的金属化合物教课ppt课件: 这是一份人教版 (新课标)必修1第三章 金属及其化合物第二节 几种重要的金属化合物教课ppt课件,共60页。PPT课件主要包含了一氧化钠和过氧化钠,的木条复燃,试管壁温度升高,溶液先变红后褪色,Na2O2,Na2O,白色固体,淡黄色固体,二碳酸钠和碳酸氢钠,白色粉末等内容,欢迎下载使用。













