





高中化学人教版 (新课标)必修1第四章 非金属及其化合物第二节 富集在海水中的元素--氯课前预习课件ppt
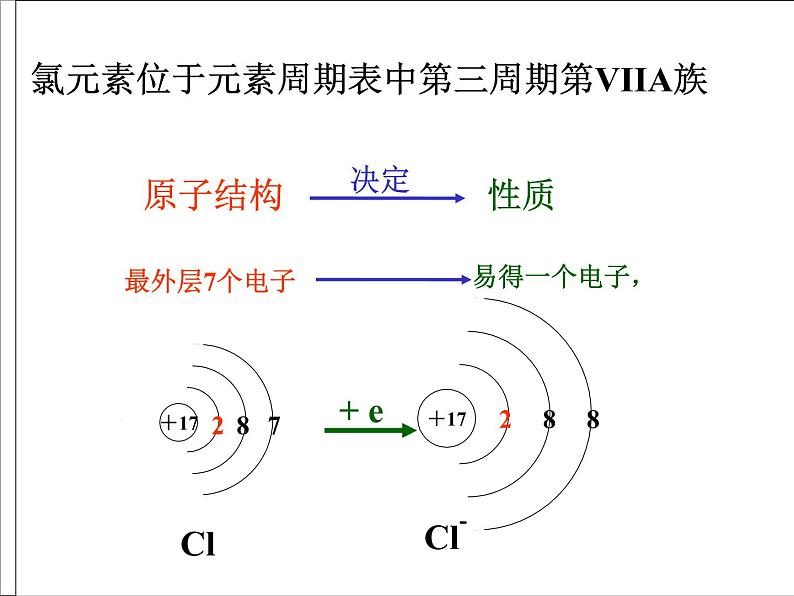
展开氯元素位于元素周期表中第三周期第VIIA族
氯元素主要以化合态存在。海水和陆地的盐矿中含有大量的氯化钠。
1915年4月22日,在比利时的小镇伊普尔,德军发起了猛烈的炮击,90分钟后联军发现了一种奇怪的黄绿色的烟雾(1)乘着北风沿地面滚滚而来,随之而来的是士兵们闻到一股刺激性气味(2)并觉得胸闷恶心,指挥官被这种情况惊呆了,吩咐士兵各自躲避,一些士兵深呼吸想减缓胸闷,但再也没有站起来,有的士兵向低洼地带(3)躲避,有的士兵喷水但也无济于事(4)晕倒后再也没有醒来(5)指挥官看到这种情形想与其全军覆没不如和敌人拚了,于是,命令士兵逆风进攻,怪事出现了,当士兵们冲过敌人前沿阵地时,原来的症状缓解了,精神一振,扩大战果,攻下了这个山峰,打扫战场时发现敌人的阵地前摆放着许多装着黄绿色液体的钢瓶(6)正是从这里发出的气体夺取了战友的生命,经研究此物质为氯气。
氯气的发现 (一战氯气视频)
氯气的发现归功于瑞典化学家舍勒,请看资料介绍:课本70页
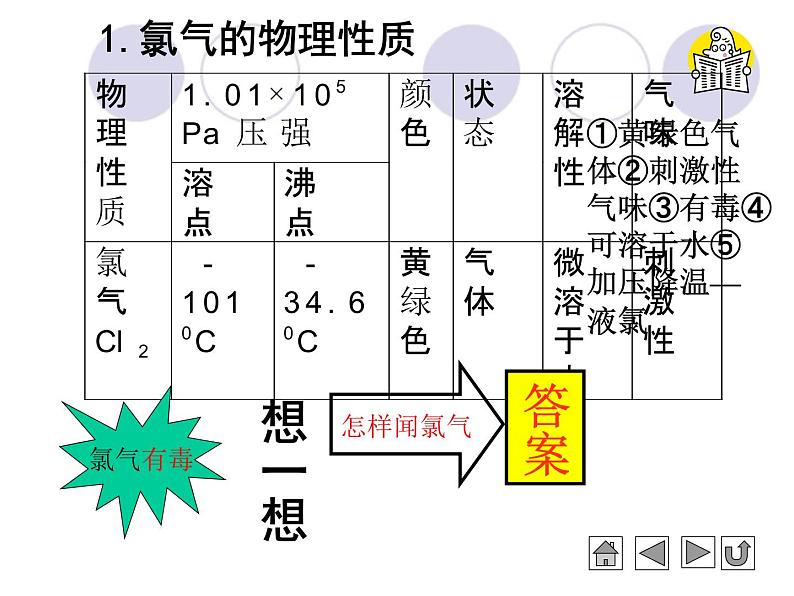
①黄绿色气体②刺激性气味③有毒④可溶于水⑤加压降温—液氯
闻氯气的方法是: 用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。 注意: 这是闻各种气体气味的方法。
2.氯气的化学性质 易得e- 氧化性
在一定条件(点燃或灼热)下氯气能与大多数金属反应生成氯化物
铜丝在氯气里剧烈燃烧,产生棕黄色的烟,产物溶于水后,溶液呈蓝绿色。
Cu + Cl2 === CuCl2
铁丝剧烈燃烧,产生—————色的————
2Fe + 3 Cl2 === 2 FeCl3
FeCl3和CuCl2能用它们的金属与盐酸反应制取吗?
反应规律:生成高价的氯化物
2Na + Cl2 === 2 NaCl
剧烈燃烧,火焰呈————色,产生————
一定条件(点燃或光照)下氯气能与氢气反应
H2 + Cl2 === 2HCl
纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有白雾产生;生成的气体HCl有刺激性气味,极易溶于水,遇空气中水蒸气,呈现雾状。HCl的水溶液叫氢氯酸,亦称盐酸。
实验证明,在一定条件下,Cl2还能与P、S、C等非金属直接化合。
氯气能溶于水,常温下,1体积水约溶解2体积的氯气。氯气的水溶液叫“氯水”,氯水因溶有氯气而呈黄绿色。溶解的氯气部分与水起反应,生成盐酸和次氯酸。
Cl2 + H2O === HCl + HClO
新制氯水的成分:分子Cl2 H2O HClO 离子Cl- H+ ClO-
久置氯水的成分:稀盐酸 离子Cl- H+
新制氯水(黄绿色)的性质
Cl-+Ag+====AgCl↓
2H++CO32-====CO2↑+H2O
2Fe2++Cl2====2Fe3++2Cl-
SO2+Cl2+2H2O==== 4H++2Cl-+SO42-
干燥氯气无漂白性,久置氯水呈无色
次氯酸不稳定容易分解放出氧气。当氯水受到日光照射时,次氯酸的分解速率加快。
次氯酸是一种强氧化剂,能杀菌消毒。还能使染料和有机色质褪色,可作棉、麻和纸张等的漂白剂,能漂白石蕊等指示剂 。
b强氧化性 HClO→ Cl-
c弱酸性<H2CO3
将氯气通入氢氧化钠溶液中:
Cl2 + 2NaOH === NaClO + NaCl +H2O
次氯酸钠,是漂白液的有效成分
工业上生产漂白粉(精),是通过氯气与石灰乳作用制成的。
2Cl2 + 2Ca(OH)2 === Ca(ClO)2 + CaCl2 + 2H2O
次氯酸钙,是漂白粉的有效成分
在潮湿的空气里,次氯酸钙与空气里的二氧化碳、水蒸气反应,生成次氯酸。所以漂白粉和漂白精也具有漂白、消毒作用。
Ca(ClO)2 + CO2 + H2O === CaCO3 + 2HClO
氯气跟碱反应的化学方程式有规律吗?
酸性:H2CO3>HClO
加稀HNO3,再滴入AgNO3溶液,如产生白色沉淀且不溶解,该溶液中含有Cl-。
有关反应的离子方程式是:Ag+ + Cl– == AgCl
在实验室里,氯气可以用浓盐酸与二氧化锰反应来制取
MnO2 + 4HCl(浓) == MnCl2 +2H2O +Cl2 ↑
MnO2 + 4H + +2Cl - == Mn 2+ +2H2O +Cl2 ↑
(2)除杂Cl2 (HCl、H2O) 饱和食盐水、浓硫酸
(3)收集----向上排空法
(4)尾气处理---NaOH溶液
(5)检验Cl2 ①湿润的红色布条褪色 ②湿润的淀粉KI试纸 –变蓝
氯气是一种重要的化工原料。氯气除用于消毒、制造盐酸和漂白剂外,还用于制造氯仿等有机溶剂和多种农药。氯气的用途决定于其性质,你能具体说明上述用途取决于氯气的什么性质吗?(必要时可用化学方程式表示)
结构 性质 用途
话说第一次世界大战期间,德国法西斯曾利用我发动了惨无人道的战争。一次德军与英、法军战士在比利时的伊普尔对峙,黎明时,英法军前线战壕的士兵突然看到一股阴森森的黄绿色气体逐渐向前袭来,(这是德军用炮弹施放了我)一时间黄烟滚滚,风沙大作,随着风势剧增,但见无数士兵大咳不止,疼痛难忍,以致精神失常,倒地身亡,阵地上陈尸千万,使我犯下了滔天罪行。在此,我这个不孝的子弟氯气,向大家谢罪,我要改过自新,为人类造福。
不同浓度的氯气对人体的危害
大气中氯气的浓度不得超过0.1mg/m3,生产车间不超过1mg/m3 居民区不超过0.03mg/m3。如果中毒,保持安静,注意保温,吸入少量乙醇和乙醚蒸汽或氨气。
发生氯气泄漏事件时,污染区居民切忌惊慌,应向上风向地区转移,并用湿毛巾护住口鼻;到了安全地带要好好休息,避免剧烈运动,以免加重心肺负担,恶化病情
1、下列物质中具有漂白作用是( )A、干燥氯气 B、液氯 C、新制氯水 D、露置漂白粉2、不能由单质直接化合而成的是( )A、AlCl3 B、NaCl C、FeCl2 D、CuCl2 3、在新制的氯水中滴入紫色石蕊试液,则溶液( )A、变成红色 B、呈紫色C、先变红后褪色 D、先变蓝后褪色
(原理、试剂、仪器、装置、验满、尾气处理)
1、反应物的要求和代替品?2、气体发生装置的特点:3、各仪器的名称和作用:4、排空收集气体时导气管的位置5、尾气的处理?6、整个实验过程的操作?7、工业制法的反应方程式:
⑵除杂Cl2(HCl、H2O)
⑷尾气吸收---NaOH溶液
⑸检验:湿润的淀粉KI试纸→变蓝
1、下列关于氯水的说法中正确的是:A、新制氯水中只含有Cl2和H2O分子B、新制氯水能杀菌消毒是因为Cl2有毒,能毒杀细菌C、光照氯水有气泡逸出,该气体是Cl2D、氯水放置数天后酸性增强2、下列物质能使红墨水褪色的是A、活性炭 B、二氧化碳C、NaCl溶液 D、酸化的NaClO溶液
3、当有大量Cl2逸出在周围空间时,可以用含有一定浓度某种物质的水溶液的毛巾捂住鼻子,该物质最好是:A、NaOH B、NaClC、KBr D、Na2CO3
4、实验室用二氧化锰和浓盐酸制氯气,主要操作有:①将烧瓶固定在铁架台上;②把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定铁圈放好石棉网;③向烧瓶中加入MnO2,再向分液漏斗中加入浓盐酸,并将导管放入集气瓶中;④检查装置的气密性;⑤在烧瓶上装好分液漏斗,连接好导气管。最好的实验步骤是:A、②③④①⑤ B、②①③⑤④C、②①⑤④③ D、②①③④⑤
5、下列物质既能由两种单质化合而生成,又能由单质与酸反应而生成的是:A、FeCl2 B、CuCl2 C、AlCl3 D、FeCl3 6、密闭容器中充有H2、O2、Cl2,充分燃烧后,冷却至室温,容器内无气体剩余,且所得溶液中溶质的质量分数为33.6%,则原气体中的H2、O2、Cl2的体积比为: A 、9∶4∶2 B、9∶4∶1 C、2∶1∶1 D、2∶1∶1
高中人教版 (2019)第二章 海水中的重要元素——钠和氯第二节 氯及其化合物多媒体教学ppt课件: 这是一份高中人教版 (2019)第二章 海水中的重要元素——钠和氯第二节 氯及其化合物多媒体教学ppt课件,共40页。PPT课件主要包含了复习巩固,新课导入,课堂检测,延伸拓展,CONTENS,氯气的化学性质等内容,欢迎下载使用。
人教版 (新课标)必修1第二节 富集在海水中的元素--氯课文内容ppt课件: 这是一份人教版 (新课标)必修1第二节 富集在海水中的元素--氯课文内容ppt课件,共52页。PPT课件主要包含了制氯气的反应装置,改写成离子方程式,有效成分,NaClO,防毒的方法与途径等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 氯及其化合物课堂教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 氯及其化合物课堂教学ppt课件,共14页。PPT课件主要包含了结构决定性质,氯原子,氯离子,氯气的物理性质,氯气的化学性质,3与水反应,③HClO的性质,②久置氯水,①新制氯水,随堂练习等内容,欢迎下载使用。













