




人教版 (新课标)必修1第二节 富集在海水中的元素--氯课文内容ppt课件
展开知识与能力(1)了解氯气的物理性质:色、味、态、水溶性、毒性 (2)掌握氯气的部分化学性质 (3)掌握氯水中的存在的微粒和性质 (4)掌握次氯酸的不稳定性和强氧化剂,理解它漂白的原理 (5)了解氯气与碱的反应,认识日常使用的漂白粉、漂白剂的主要成分; (6)了解氯气的实验室制法; 掌握氯离子的检验方法; 简单认识卤素的性质。
〖教学重点〗:氯气的化学性质氯气与碱的反应、氯离子的检验方法〖教学难点〗:氯气与水的反应氯气与碱的反应
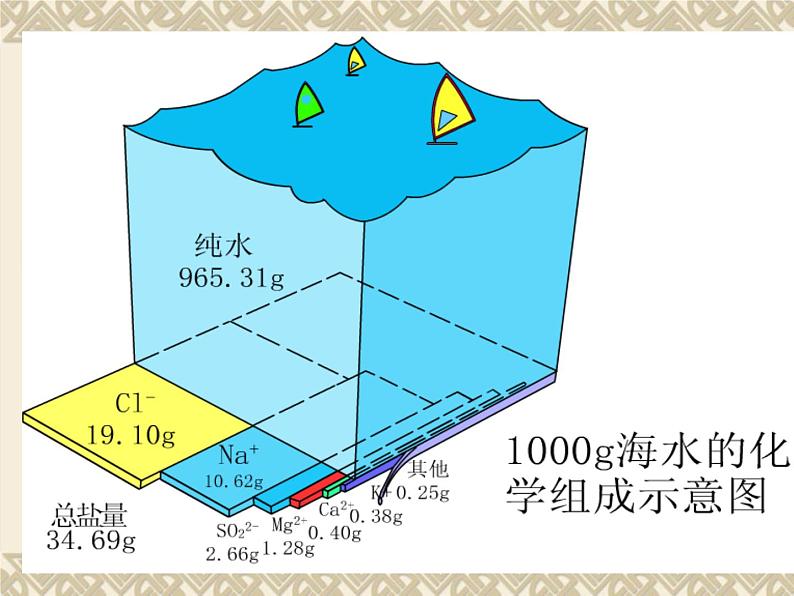
海洋是一个重要的资源宝库,大约有80多种元素蕴藏在湛蓝的海水里。在地壳中氯的含量为0.031%,大部分氯以氯化物的形式存在于表面积为36100万平方公里的海洋里,其总量约为30000万亿吨. 氯是人体所必须的宏量元素之一。人体中氯的含量一般为0.12%,这它主要存在于细胞外液中。缺少了它,人体机能就会失调。我们每天都需要食用食盐(主要成分为氯化钠),原因之一就是要满足人体对氯元素的需要。
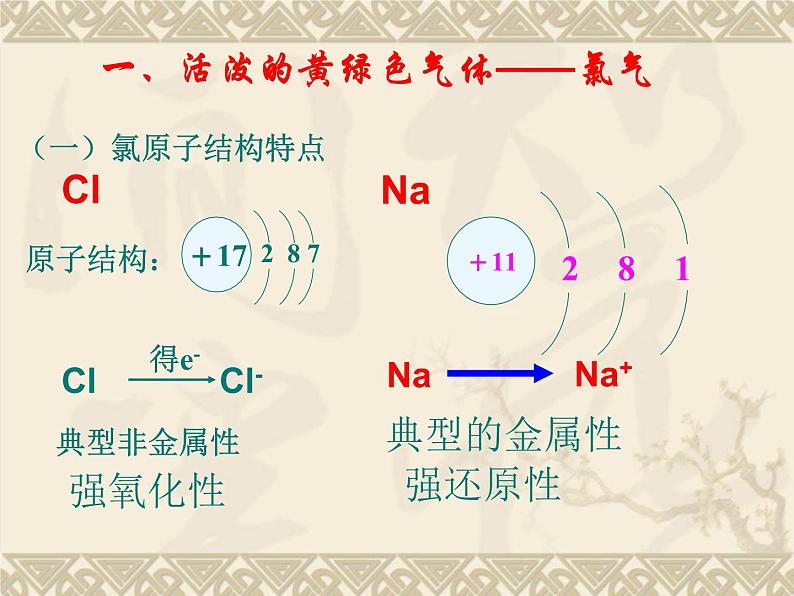
(一)氯原子结构特点
一、活泼的黄绿色气体——氯气
自然界无游离态的钠
(金属钠——强还原性)
自然界无游离态的氯
(氯气——强氧化性)
在实验室里,氯气可以用浓盐酸与二氧化锰反应来制取
请用双线桥法标出电子的转移,得失以及化合价的升降
2.浓盐酸表现出 性和 性
注: 1.MnO2为难溶于水的黑色固体 2.稀盐酸与MnO2不反应 3.反应要加热。
MnO2+4H+ +2Cl- ==Mn2++Cl2↑+2H2O
(1)氯气是黄绿色(2)有刺激性气味,有毒的气体(3)易液化(4)密度比空气大(5)能溶于水(1体积水可溶解2体积氯气)
不能用排水法收集,可用排饱和食盐水法收集
闻氯气的方法是: 用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。 注意: 这是闻各种气体气味的方法。
若有氯气泄漏,周围的人 往高处走还是往低处走? 应顺风走还是逆风走?
反应规律:生成高价金属的氯化物
2.怎样制取FeCl2?
1.下列化合物中,不能由氯气和相应的金属直接反应来制取的是A. FeCl3 B. CaCl2 C. FeCl2 D. KCl
纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。
氢气和氯气的混合气体 光照或点燃后发生爆炸。
(2)氯气与非金属反应
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?
燃烧: 燃烧不一定要有氧气参加, 燃烧的本质是氧化还原反应。 任何发光发热的剧烈的化学反应叫做燃烧。
思考1:同学们打开自来水时,有没有闻到一股气味呢?为什么会有这种气味,其中放了什么呢?
什么叫氯水?250C时,一体积水可以溶解多少体积的氯气?
自来水厂用氯气杀菌,消毒,闻到的刺激性气味是余氯的气味
Cl2 + H2O =
HCl + HClO
溶于水中的部分Cl2与水反应
1体积的水能溶解2体积的Cl2
Cl2能溶于水
Cl2既是氧化剂,又是还原剂
请将其改写成离子方程式
Cl2 + H2O =2H+ +2Cl- +O2-
Cl2 + H2O =2H+ +Cl- +ClO-
Cl2 + H2O =H+ +Cl- +HClO
3.强氧化性 漂白作用
可用于自来水的杀菌、消毒,可用做漂白剂。
酸性:H2CO3 >HClO
实验探究:请你设计一个实验验证具有漂白性的是次氯酸而不是氯气.
结论:1.干燥的氯气没有漂白性
2.湿润的氯气有漂白性,因为氯气溶于水生成次氯酸.
3.尾气用NaOH溶液吸收
液氯与氯水的区别?新制氯水与久置氯水的区别?
Cl2 ,HClO,H2O
H+,Cl-,ClO-
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
1.自来水可以用氯气消毒,如果实验室中无蒸馏水,可以用自来水配某些急需的药品,但有些药品若用自来水配制,则会明显导致药品变质.下列哪些药品不能用自来水配制:A.Na2SO4 D.AlCl3
2.下列关于氯水的叙述中正确的是A.新制氯水中只含有Cl2和H2O分子B.新制的氯水可使蓝色石蕊试纸先变红后褪色.C.光照氯水有气泡逸出,该气体是Cl2D.氯水放置数天后,酸性增强.
阅读课本氯气与碱的反应
Cl2+ NaOH —
(1).氯气与烧碱反应的化学方程式
写出Cl2与烧碱反应的方程式
Cl2+2NaOH = NaCl+NaClO+H2O
标出电子转移的方向和数目
Cl2+2OH- = Cl-+ClO-+H2O
该反应用于制漂白液
写出氯气被石灰水吸收的反应方程式
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
Cl2+Ca(OH)2 ——
标出电子转移的方向和数目
CaCl2 Ca(ClO)2可溶于水吗?
漂粉精可用于游泳池的消毒
为什么不直接用次氯酸作漂白剂?
次氯酸不稳定,次氯酸盐较稳定
怎样保存漂白粉?
密封存放于避光干燥处
[讨论]若你的周围不幸发生氯气泄漏事故,你该怎样处理?
用碱液吸收
实验室制Cl2时,尾气中的Cl2应怎样处理?
NaOH溶液
Ca(OH)2溶液
2004年4月重庆天原 化工总厂氯气泄漏事故
2004年4月重庆天原化工总厂氯气泄漏事故中消防战士正在调制碱水喷洒液
当周围有大量Cl2逸出时,可用含有某种物质的水溶液的毛巾捂住鼻子,该物质最好是:A、NaOH B、NaClC、Ca(OH)2 D、Na2CO3
1、用Cl2消毒的自来水配制下列溶液,不会引起药品变质的是( )
A NaCl B AgNO3 C NaOH D Ca(OH)2
2、下列物质中,不能使有色布条褪色的是 ( )
A NaClO溶液 B Ca(ClO)2 溶液
C 氯水 D CaCl2溶液
(3)处理工业废水,将具有还原性的有毒物质硫化氢、氰化物等氧化成无毒物。
(1)SiCl4、GeCl4、TiCl4分别是制取高纯硅、锗(半导体)和金属钛的重要中间物质;
(2)合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料;
二、氯离子(Cl-)的检验
Cl- + Ag+ =AgCl↓
CO32- +2Ag+ =Ag2CO3↓
Ag2CO3+2H+=2Ag++CO2↑ + H2O
检验Cl-时,为什么滴加AgNO3 溶液后还要再加稀硝酸呢?
因为 AgNO3溶液除可以与Cl-形成AgCl白色沉淀外,还可以与CO32-形成Ag2CO3白色沉淀,但AgCl不与稀硝酸反应; 而Ag2CO3可与稀硝酸反应,沉淀可溶解。
氯离子检验的一般步骤:
①最外层电子都有7个电子,易得到一个电子;
③都能与Na、K、Ca、Mg等金属化合生成盐,所以统称为卤素(成盐元素之意)。
②都是典型的非金属元素;
卤素单质氧化性的比较:
随元素原子核电荷数的增大,原子半径增大,得电子能力减弱,故氧化性减弱
氧化性:F2 Cl2 Br2 I2
碘化银(AgⅠ)被用于人工降雨
高中人教版 (2019)第二章 海水中的重要元素——钠和氯第二节 氯及其化合物多媒体教学ppt课件: 这是一份高中人教版 (2019)第二章 海水中的重要元素——钠和氯第二节 氯及其化合物多媒体教学ppt课件,共40页。PPT课件主要包含了复习巩固,新课导入,课堂检测,延伸拓展,CONTENS,氯气的化学性质等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第四章 非金属及其化合物第二节 富集在海水中的元素--氯课前预习课件ppt: 这是一份高中化学人教版 (新课标)必修1第四章 非金属及其化合物第二节 富集在海水中的元素--氯课前预习课件ppt,共33页。PPT课件主要包含了Cl-,原子结构,想一想,氯气的物理性质,1氯气与金属反应,2氯气与氢气反应,3氯气与水反应,4氯气与碱反应,氯气与铜反应,请看实验等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 氯及其化合物课堂教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 氯及其化合物课堂教学ppt课件,共14页。PPT课件主要包含了结构决定性质,氯原子,氯离子,氯气的物理性质,氯气的化学性质,3与水反应,③HClO的性质,②久置氯水,①新制氯水,随堂练习等内容,欢迎下载使用。













