





2020-2021学年8.2 常见的酸和碱课文课件ppt
展开
这是一份2020-2021学年8.2 常见的酸和碱课文课件ppt,共60页。PPT课件主要包含了酸碱盐溶液的导电性,课堂练习,请多指导,课后练习,常见的碱,碱的化学性质,了解溶液酸碱度的意义,酸的化学性质等内容,欢迎下载使用。
课题1 常见的酸和碱第1课时酸、碱指示剂
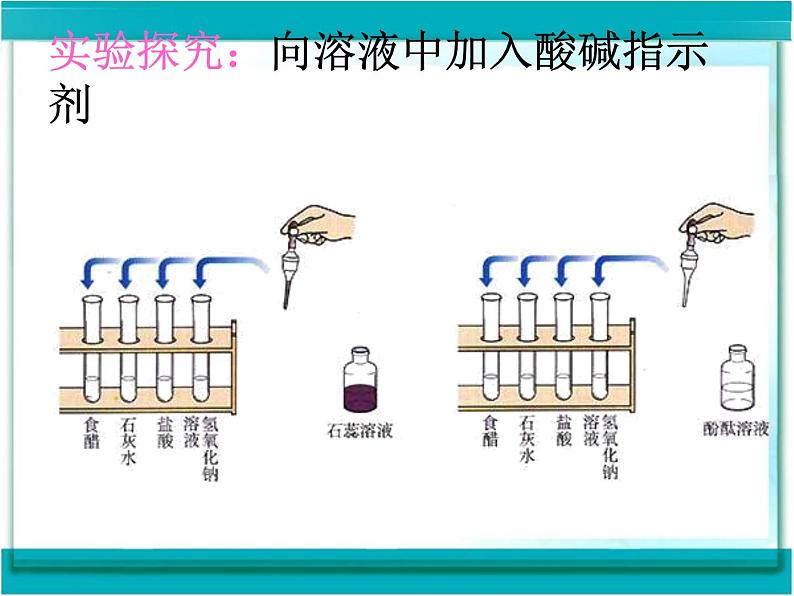
1、把二氧化碳通入紫色石蕊的试管中会看到什么现象?该现象说明了什么?2、在右图的实验中,可以看到什么现象?这说明酚酞试液有什么性质?
实验探究:向溶液中加入酸碱指示剂
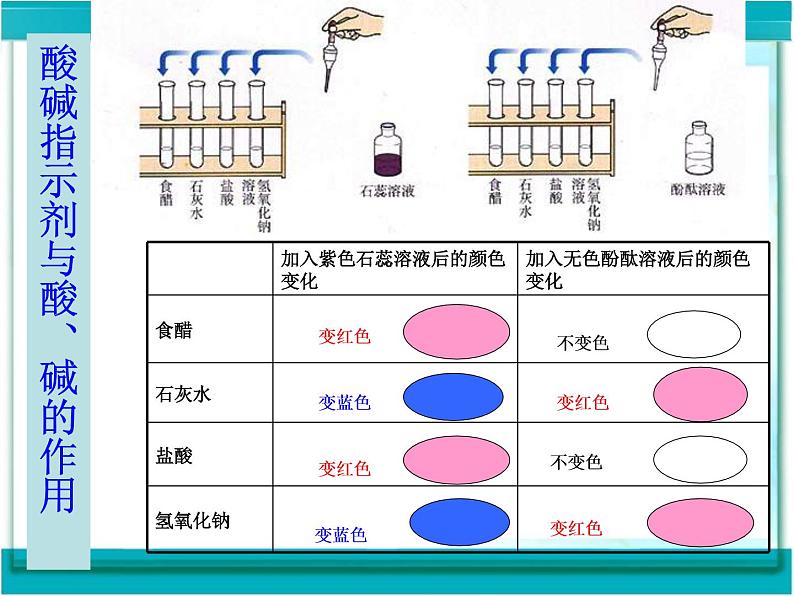
酸碱指示剂与酸、碱的作用
以上四种物质,哪些可能是酸,哪些可能是碱?
紫色石蕊溶液遇酸溶液变红色 无色酚酞溶液遇酸不变色 紫色石蕊溶液遇碱溶液变蓝色 无色酚酞溶液遇碱溶液变红色
石酸红,酚酸无, 石碱蓝,酚碱蓝
像石蕊和酚酞这种能跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。石蕊和酚酞是常见的两种酸碱指示剂
注意:酸碱指示剂与酸或碱的溶液反应时, 变色的是指示剂,而不是酸碱。
自制酸碱指示剂
收集不同颜色的新鲜花瓣或紫萝卜皮,各取适量,研碎,加入适量水和酒精(两者体积比为1:1),浸泡,过滤,得到植物色素提取液。将提取液分别装入小试剂瓶中备用。将上述植物色素提取液分别滴入白醋、蒸馏水、澄清石灰水中,观察颜色的变化,并记录。选择颜色变化明显的植物色素提取液作为酸碱指示剂,并检验稀盐酸、氨水、食盐水等溶液的酸碱性。
一般花瓣内通常含有两种色素。这些色素在不同的温度、不同的酸碱性环境下,呈现不同的颜色。不同的花,花瓣中两种色素的含量不同,由于花瓣内的酸碱性不同,因此花会呈现不同的颜色。同一种花,在开放的不同时期,花瓣中两种色素的含量不同,花瓣内的酸碱性不同,花也呈现不同的颜色。这就有“百花盛开,万紫千红”美丽景观的描绘。
设问:为什么酸溶液通常能使紫色石蕊试液变红,而使无色酚酞试液不变色;碱溶液通常能使紫色石蕊试液变蓝,而使无色酚酞试液变红呢?那到底什么是酸,什么是碱呢?
请自学书上P56——57的相关内容后回答
1、酸、碱、盐溶于水,在水中是以什么样的微粒存在的?2、电离需要通电吗?3、酸在水溶液中含有的相同微粒是什么?4、碱在水溶液中含有的相同微粒是什么?5、酸、碱的溶液能使指示剂变色的原因是什么?6、你能试着给酸或碱下定义吗?
1、酸:电离生成的阳离子全都是氢离子的化合物。2、碱:电离生成的阴离子全都是氢氧根离子的化合物。3、盐:电离生成金属离子和酸根离子的化合物。
1、判断下列物质的类别:硫酸铜 盐酸 氢氧化钠 氯化镁碳酸 氢氧化钡硫酸亚铁 氨水氯化铵 碳酸氢钠水 氧化铜
2、著名化学家罗伯特·波义耳在一次实验中,不小心将盐酸溅到紫罗兰花瓣上,过一会儿,他惊奇地发现,紫色的花瓣上出现了红点点。波义耳对这一意外的发现,做出了各种假设,经过多次实验验证,探究普遍规律,终于获得了成功。对紫罗兰花瓣遇盐酸变红的现象,你有哪些假设?请将实验方案填写在下表中:
3、下图是某同学在电脑屏幕上绘制的酸、碱、盐电离图片,○表示H+,●表示Na+,●表示OH-,●表示Cl-,其中描述的是酸的电离的是( )
4、下图是试验物质导电性的实验,其中灯泡不亮的是 ( )
5、含有下列离子的溶液中,溶质全部为酸的是 ( ) A.H+、Na+、SO42- B.H+、Cl-、NO3- C.OH-、K+、Ba2+ D.Ag+、K+、NO3-
课题1 常见的酸和碱
(第二课时 常见的酸)
课题1 常见的酸和碱
生活中的一些物质含有酸
食醋中含有醋酸 汽车用铅蓄电池中含有硫酸
柠檬、柑橘等水果中含有柠檬酸
答:浓度变小 , 质量变小 .
(1) 酸与指示剂的作用
Mg+2HCl=H2+ZnCl2
Mg+H2SO4=H2+MgSO4
Zn+2HCl=H2 + ZnCl2
Zn+H2SO4=H2 + ZnSO4
Fe+2HCl=H2 + FeCl2
Fe+H2SO4=H2 + FeSO4
(3)酸与金属氧化物反应
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
铁锈逐渐消失,溶液由无色变黄色
(1)上面反应的生成物有什么共同之处?(2)利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?
Fe +2HCl= H2 + FeCl2
答:稀硫酸受热水分蒸发变成浓硫酸,浓硫酸有强烈的腐蚀性,能夺取纸张里的水分,生成黑色的炭.
学完本节课,试归纳出酸有哪些相似的化学性质?
(第三课时 常见的碱)
1. 氢氧化钠(NaOH)
氢氧化钠吸收空气中的水分
①氢氧化钠是白色的固体。②氢氧化钠暴露在空气中容易吸收水分,表面潮湿并逐渐溶解。这种现象叫做潮解。③氢氧化钠可用做某些气体的干燥剂(如:H2、O2等)。④氢氧化钠极易溶于水,溶解时会放出大量的热。
1.氢氧化钠有强烈的腐蚀性,其俗名叫苛性钠、火碱或烧碱。2.如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
2. 氢氧化钙[ Ca(OH)2 ]
CaO + H2O = Ca(OH)2
(1)氢氧化钙也有腐蚀性,使用时应注意安全。(2)常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)等。
1.碱溶液能使紫色的石蕊溶液变蓝色,使无色的酚酞溶液变红色。
2.碱能与某些非金属氧化物反应
2NaOH + CO2 = Na2CO3 + H2O
Ca(OH)2+CO2=CaCO3↓+H2O(检验CO2)
氢氧化钠放置在空气中会发生变质,所以氢氧化钠必须密封保存。
【思考】不同的酸为什么有相似的化学性质?
不同的碱为什么也有相似的化学性质?
HCl → H+ + Cl-
H2SO4→2H+ + SO42-
NaOH → Na+ + OH-
Ca(OH)2→ Ca2+ + 2OH-
酸在水溶液中都能解离出H+和酸根离子,即在不同的酸溶液中都含有相同的H+,所以酸有一些相似的性质。
碱溶液中也含有相同的OH-,所以,碱也有一些相似的性质。
三、溶液酸碱度的表示法
(如NaCl溶液、Na2SO4溶液的PH=7)
【方法】将被测液体滴到pH试纸上,把试纸显示的颜色与标准比色卡比较。
【思考】 如何测定溶液的PH
测定PH最简便的方法是:使用PH试纸
1.化工生产中许多反应必须在一定pH溶液里进行。
2.农作物一般适宜在pH为7或接近7的土壤中生长。
3.测定雨水的pH,可以了解空气的污染情况。
4.测定人体内或排除的液体的pH,可以了解人体的健康状况。
【题1】某溶液的PH=3,则该溶液( )A. 呈酸性 B. 呈碱性 C. 呈中性 D. 无法判定
【题2】已知苹果汁的近似PH为2.9~3.3,在苹果汁中滴入紫色石蕊试液,显示的颜色是( )A. 无色 B. 红色 C. 蓝色 D. 紫色
【题3】下列各PH表示溶液酸性最强的是( )A. PH=14 B. PH=7 C. PH=1 D. PH=0
【题4】有一瓶无色溶液的PH是4.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的PH升为10,可以采取______________________的方法。
【题5】有一瓶无色溶液的PH是9.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的PH降为5,可以采取______________________的方法。
【题6】若将潮湿的空气依次通过烧碱溶液、浓硫酸和红热的铜网,将会依次除去空气中的_____、________、和________,最后剩余的气体主要是_______。
【题7】下列气体中,既能用固体NaOH干燥又能用浓H2SO4干燥的是( ) A. CO2 B. HCl C. SO2 D. O2
【解析】干燥原理:干燥剂只吸收水分,但不能与被干燥的气体发生反应。CO2、SO2、HCl都能与NaOH反应,故三者均不能用NaOH来干燥,而O2既不能与NaOH反应,也不能与浓H2SO4反应,故用浓H2SO4、 NaOH干燥都可以。
【题8】将混有少量氧化铜的铁粉,加入到盛有稀硫酸的烧杯中,充分反应,有部分铁剩余,过滤后,滤液中含有的溶质是( ) A. H2SO4 B. FeSO4 C. FeSO4和CuSO4 D. H2SO4和FeSO4
酸的化学性质1、跟指示剂的反应2、跟金属的反应3、跟金属氧化物的反应4、跟碱的反应5、跟某些盐反应
(5)酸跟盐发生的反应
已知鸡蛋壳的主要成分是碳酸钙,知识回忆 ↙
CaCO3+2HCl=CaCl2+H2O+CO2↑
补充1:盐酸跟硝酸银的反应
实验步骤:在盛有少量稀盐酸的试管中滴入几滴硝酸银溶液,观察现象。
补充2:硫酸跟氯化钡的反应
实验步骤:在盛有少量稀硫酸的试管中滴入几滴氯化钡的溶液,观察现象
H2SO4+BaCl2=BaSO4↓+2HCl
小结:酸+盐==另一种酸+另一种盐
P 58 T 2、3、4
相关课件
这是一份2020-2021学年9.3 化学能的利用课文配套ppt课件,共15页。PPT课件主要包含了知识网络,化学能的利用,已开发的能源类型,化学电池,知识点1能源,知识回顾,化石燃料,太阳能,清洁高效,放出大量热等内容,欢迎下载使用。
这是一份初中化学科粤版九年级下册第八章 常见的酸、碱、盐8.4 常用的盐教学课件ppt,共36页。PPT课件主要包含了一盐的广泛用途,食盐NaCl,氯化钠与人体健康,我国食盐产地,海水晒盐,馒头的故事,检测题一等内容,欢迎下载使用。
这是一份2021学年第八章 常见的酸、碱、盐8.2 常见的酸和碱教课课件ppt,共30页。PPT课件主要包含了常见的酸,常见的碱,稀酸的化学性质,碱溶液的化学性质,可做干燥剂,浓硫酸有强吸水性,浓硫酸稀释方法,经典例题,知能训练,End等内容,欢迎下载使用。









