
高中化学人教版 (2019)必修 第一册第二节 离子反应学案
展开
这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应学案,共4页。学案主要包含了学习目标,重点、难点,内容设计等内容,欢迎下载使用。
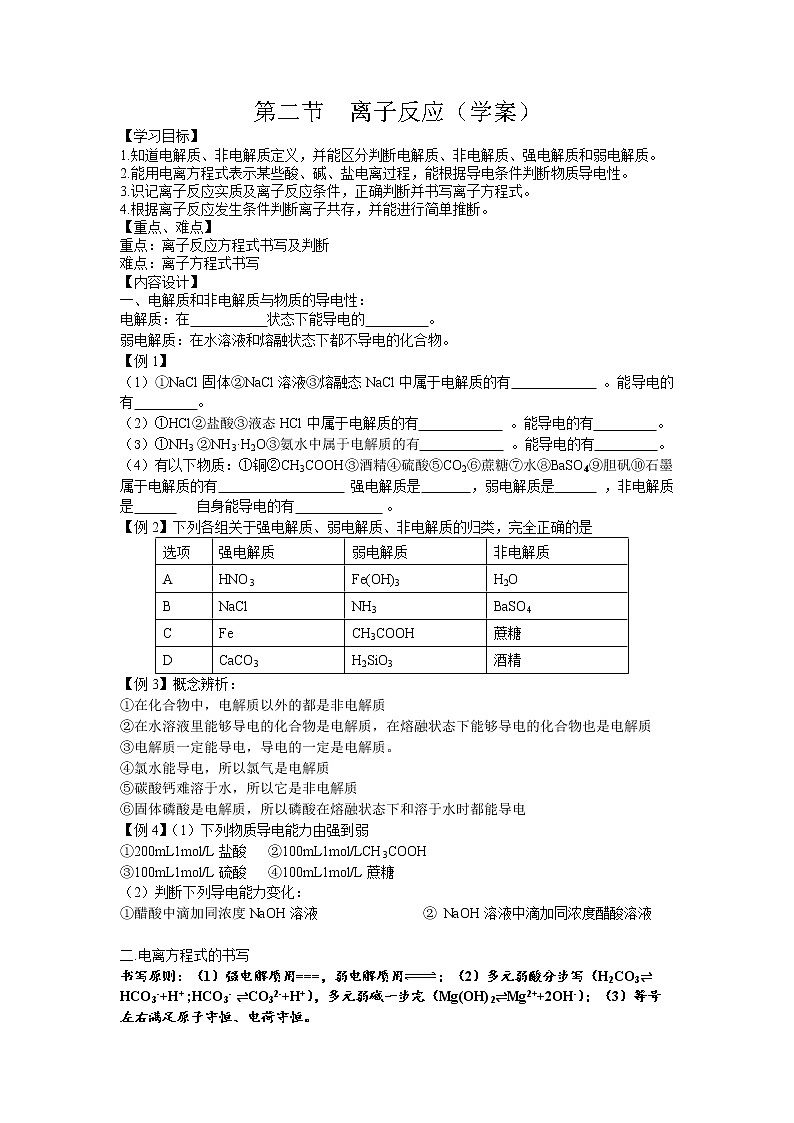
第二节 离子反应(学案)【学习目标】1.知道电解质、非电解质定义,并能区分判断电解质、非电解质、强电解质和弱电解质。2.能用电离方程式表示某些酸、碱、盐电离过程,能根据导电条件判断物质导电性。3.识记离子反应实质及离子反应条件,正确判断并书写离子方程式。4.根据离子反应发生条件判断离子共存,并能进行简单推断。【重点、难点】重点:离子反应方程式书写及判断难点:离子方程式书写【内容设计】一、电解质和非电解质与物质的导电性:电解质:在 状态下能导电的 。弱电解质:在水溶液和熔融状态下都不导电的化合物。【例1】(1)①NaCl固体②NaCl溶液③熔融态NaCl中属于电解质的有 。能导电的有 。(2)①HCl②盐酸③液态HCl中属于电解质的有 。能导电的有 。(3)①NH3 ②NH3·H2O③氨水中属于电解质的有 。能导电的有 。(4)有以下物质:①铜②CH3COOH③酒精④硫酸⑤CO2⑥蔗糖⑦水⑧BaSO4⑨胆矾⑩石墨 属于电解质的有 强电解质是 ,弱电解质是 ,非电解质是 自身能导电的有 。【例2】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是选项强电解质弱电解质非电解质AHNO3Fe(OH)3H2OBNaClNH3BaSO4CFeCH3COOH蔗糖DCaCO3H2SiO3酒精【例3】概念辨析:①在化合物中,电解质以外的都是非电解质②在水溶液里能够导电的化合物是电解质,在熔融状态下能够导电的化合物也是电解质③电解质一定能导电,导电的一定是电解质。④氯水能导电,所以氯气是电解质⑤碳酸钙难溶于水,所以它是非电解质⑥固体磷酸是电解质,所以磷酸在熔融状态下和溶于水时都能导电【例4】(1)下列物质导电能力由强到弱①200mL1mol/L盐酸 ②100mL1mol/LCH3COOH ③100mL1mol/L硫酸 ④100mL1mol/L蔗糖(2)判断下列导电能力变化:①醋酸中滴加同浓度NaOH溶液 ② NaOH溶液中滴加同浓度醋酸溶液 二.电离方程式的书写书写原则:(1)强电解质用===,弱电解质用;(2)多元弱酸分步写(H2CO3⇌HCO3-+H+ ;HCO3- ⇌CO32-+H+),多元弱碱一步完(Mg(OH)2⇌Mg2++2OH-);(3)等号左右满足原子守恒、电荷守恒。①H2CO3: ;②NH3•H2O: ;③KClO3: ;④Al2O3(熔融) ; ⑤胆矾: ;⑥CH3COONH4: ;判断:溶液中NaHSO4===Na++H++SO42﹣ NaHSO4(熔融)===Na++HSO4﹣溶液中NaHCO3===Na++HCO3﹣变式.下列电离方程式正确的是A. NaHCO3=Na++H++ CO32- B. H2SO32H++SO32-C. Ba(OH)2=Ba2+ + 2OH- D. AgCl Ag++Cl-三、离子反应方程式书写及判断:1.离子反应条件:1)复分解反应发生的条件: , , 。2)离子反应实质:反应向着离子浓度减小的方向进行。离子反应条件:2.(1)写出下列离子方程式 拆分是关键 ①硫酸和氢氧化钠反应 写: 。拆: 。删: 。查:左边的电荷总数为 右边的电荷总数为 。变式:硫酸和氢氧化钡反应 写: 。拆: 。删: 。查:左边的电荷总数为 右边的电荷总数为 。 ②CO2通入澄清石灰水 。③ 用CH3COOH溶解CaCO3: ④向盐酸中滴加氨水: 三、离子方程式的意义:既可以代表一类反应又可以代表一个反应1.下列反应能用离子方程式CO32-+2H+=H2O+CO2↑① ② ③④ 2.下列化学方程式中,不能用离子方程式Ba2+ + SO42- = Ba SO4 ↓表示的是( )A Ba(NO3)2 + H2SO4 = Ba SO4 ↓+2 H NO3 B BaCl2 + Na2SO4 = Ba SO4 ↓+2 NaClC BaCO3 + H2SO4 = Ba SO4 ↓+ H2O + CO2 ↑ D BaCl2 + H2SO4 = Ba SO4 ↓+2HCl3.可以用H++ OH-= H2O来表示的化学反应有?①盐酸和Cu(OH)2的反应②醋酸和NaOH的反应③ NaHSO4和KOH反应④H2SO4与澄清石灰水反应⑤NaHSO4溶液与Ba(OH)2溶液混合 ⑥NH4Cl溶液与Ca(OH)2溶液混合⑦HNO3溶液与KOH溶液混合 ⑧NaHPO4溶液与NaOH溶液混合四、与量有关离子方程式书写:如果把过量的CO2通入到澄清石灰水中,看到的现象是先变浑浊后又变澄清,为什么?1.连续型(1) 少量酸性氧化物(如CO2、SO2)+碱===_____________(填“正盐”或“酸式盐”)(2) 过量酸性氧化物(如CO2、SO2)+碱===_____________(填“正盐”或“酸式盐”)2.“少定多变”的应用“少定多变”指对于反应物,谁少定谁为“1”,过量的反应物根据需要定量。向Ca(HCO3)2溶液中滴加NaOH溶液:若加入少量NaOH,则NaOH设为“1”,实际参加的OH-系数为______,消耗HCO3-系数为______,则离子方程式为:_____ OH-+_____ HCO3- ===_____+____H2O:若加入过量NaOH,则_________设为“1”,Ca2+系数为________,HCO3-系数为________,消耗OH-系数为______,则离子方程式为:____Ca2++_____ OH-+_____ HCO3-===_____CaCO3↓+____H2O+ ____CO32- 3.定比例型(分三步进行:①确定参加反应的离子②根据限定条件确定反应物系数③写出生成物并配平)例如:向NaHSO4溶液中滴加Ba(OH)2,若使SO42-完全沉淀,设SO42-为1mol,消耗Ba2+_____mol,NaHSO4中H+_______mol,消耗________mol OH-,则离子方程式为______________________;4.“先后”问题(与OH-反应先后H+>NH4+,与H+反应先后,OH->CO32-> HCO3-)例如:向NH4HSO4溶液中滴加NaOH,NaOH少量时,发生的离子反应为________________________NaOH过量时,发生的离子反应为________________________五、离子共存:1.知识储备:1)溶液中常见离子的颜色:Cu2+:蓝色 Fe2+:浅绿色 Fe3+:黄色 MnO4-:紫红色2) 溶液的酸碱性与指示剂之间的关系酸(石蕊) 色,碱(石蕊) 色;酸(酚酞) 色, 碱(酚酞) 色3.)判断下列物质的溶解性:Mg(OH)2、Cu(OH)2、Al(OH)3、MgSO4、CuSO4追问:Ca(OH)2、CaSO4、Ag2SO4、MgCO3溶解性? 2.离子共存 1离子共存即离子间不能发生反应,若反应则不共存,常见的不共存指发生复分解反应而不共存。快速判断下列各组离子能否大量共存(直接划“√”“×”) 沉淀类型:①Ag+ OH- ②Ag+ SO42- ③Ba2+ SO32- ④Mg2+ CO32- 气体类型:①H+ SO32- ②H+ HCO3- 弱电解质类:①OH- HCO3- ②H+ ClO- 2)判断离子共存时,需分析题干中隐含的酸碱性或已存在某些离子,还需分析“可能共存”、“一定共存”等字眼。请同学们结合以上提示,判断下列各组离子能否共存。若不共存,圈出不共存的离子。①Mg2+、Cl-、SO42-、K+ ② Na+、Cl-、OH-、NH4+③ 澄清透明溶液:K+、Cu2+、Cl-、SO42- ④无色透明溶液:Na+、K+ 、Cl-、MnO4-⑤使酚酞变红的溶液:K+、Cl-、NO3-、Mg2+ ⑥与铁反应生成H2:Na+、Mg2+、SO42- 、HCO3-⑦下列各组离子能共存且加稀盐酸酸化后仍能共存的是:A.K+、Ag+、NO3- B.Na+、K+、NO3-例1:某无色溶液既可能是强酸性又可能是强碱性,在该溶液中一定能大量共存的离子是?①H+ Na+ MnO SO ②CH3COO-、Na+、K+、SO42- ③K+ Na+ Cl- SO ④ K+ Cl- Ba2+ HCO例2:下列各组离子,在溶液中能大量共存、加入盐酸后既有气体放出又有沉淀生成的一组是 A.Ba2+、NO3-、NH4+、Cl- B.Na+、HCO3-、NH4+、Ag+ C.K+、Ba2+、SO42-、HCO3- D.Na+、Mg2+、SO42-、K+ 3、离子共存的应用已知甲、乙两溶液中含有Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-八种离子(每种溶液中含有4种离子),已知甲溶液呈碱性,则甲溶液中含有的四种离子为?乙溶液中含有的四种离子为六、离子检验与推断:①无情景的离子检验SO4 2-检验:Cl-检验:②有情景的离子检验(如用BaCl2除去溶液中的SO4 2-,如何确定SO4 2-已除尽是否沉淀完全的离子检验③沉淀洗涤的方法?用玻璃棒引流,向漏斗中加水至浸没沉淀,待水流出后重复操作2-3次。④如何判断已洗净?取最后一次的洗涤液少量于试管中,滴加xx溶液,若无沉淀产生,则证明沉淀已洗净。2.离子推断的原则:①肯定性原则②互斥性原则(肯定一些离子的同时否定一些离子的存在)③电中性原则(溶液中的阴阳离子同时存在且电荷数相等)④进出性原则(实验过程中反应生成的离子或引入的离子对后续实验的干扰)1.某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、CO、NO。现进行如下实验:(1)用红色石蕊试纸检验,试纸变蓝色。(2)另取少量溶液逐滴滴加盐酸至过量,无气体放出,再加入BaCl2溶液后,没有沉淀生成。(3)另取少量溶液用硝酸酸化后,加入AgNO3溶液有白色沉淀生成。根据上述实验推断:原溶液中肯定有________离子,肯定没有________离子,不能肯定存在________离子。 2.某混合溶液可能含有的离子 Na+、 NH4+ 、 NO3-、CO32-、SO42-、Cl-、 OH-,为鉴定这些离子,分别取少量溶液进行以下实验: ①测得混合液呈碱性。 ②加盐酸后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊。 ③加 BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解。 ④取③中的溶液,加 HNO3酸化后,再加过量 AgNO3,溶液中析出白色沉淀。 一定存在的离子有_________,一定不存在的离子有________,可能存在的离子有____________。【例1】.在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售。为辨别真伪,可用以鉴别的一种试剂是 ( )A.酚酞试液 B.氯化钡溶液 C.氢氧化钠溶液 D.硝酸银溶液【例2】.一种无色溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,则该溶液中含有的离子是( )A.一定含有SO42- B.一定含有CO32-C.一定含有Ag+ D.可能含有SO42-,也可能含有Ag+
相关学案
这是一份人教版 (2019)必修 第一册第二节 离子反应导学案及答案,共10页。学案主要包含了学习目标,基础知识,实验1-2,实验1-3,考点剖析等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第二节 离子反应第二课时导学案,共9页。
这是一份2021学年第一章 物质及其变化第二节 离子反应导学案,文件包含必过04离子反应原卷版docx、必过04离子反应解析版docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。